
| A.混合溶液中c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-) |
| B.混合溶液中c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-) |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中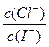 约为1.02×103 约为1.02×103 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
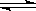 Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少
Mg2++ 2OH―,加入下列哪种固体物质可使Mg(OH)2固体的质量减少| A.Na2CO3 | B.MgCl2 | C.NH4Cl | D.NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
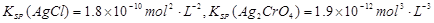 。则下列叙述正确的是 ( )
。则下列叙述正确的是 ( )| A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明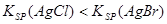 |
| C.将0.001mol·AgNO3溶液滴入0.001mol·L-1KCl和0.001mol·L-1K2CrO4混合溶液中,产生Ag2CrO4 |
| D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 5Ca2++3 PO43-+OH-。已知Ca5(PO4)3F(s)的溶解度比a5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )
5Ca2++3 PO43-+OH-。已知Ca5(PO4)3F(s)的溶解度比a5(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。以下措施中不能保护牙齿的是( )| A.饮用纯净水 | B.在牙膏中添加适量的Ca2+或PO43-离子 |
| C.在饮用水中加入适量氟化物添加剂 | |
| D.在牙膏中加入氟化物添加剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:
的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
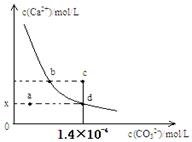
| A.x的数值为2×10-5 | B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成a点 | |
| D.b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据Ksp(AgCl)=1.77×10-10mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12mol3·L-3,可以推知AgCl的溶解度比Ag2CrO4的溶解度大 |
| B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体最终得不到ZnS沉淀是因为溶液中c(Zn2+)·c(S2-)<Ksp(ZnS) |
| C.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量大 |
| D.向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com