
【题目】下列事实不能用勒夏特列原理解释的是
A.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.对2HI ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
D.NO2气体被压缩后,颜色先变深后变浅
【答案】C
【解析】
根据勒夏特列原理进行分析;
A、该反应是可以拆写成Fe3++3SCN-![]() Fe(SCN)3,加入KSCN,增加c(SCN-),使平衡向正反应方向进行,溶液颜色加深,符合勒夏特列原理,故A不符合题意;
Fe(SCN)3,加入KSCN,增加c(SCN-),使平衡向正反应方向进行,溶液颜色加深,符合勒夏特列原理,故A不符合题意;
B、合成氨N2(g)+3H2(g) ![]() 2NH3(g),将氨气液化,相当于减少生成物浓度,平衡向正反应方向进行,有利于氨的生成,符合勒夏特列原理,故B不符合题意;
2NH3(g),将氨气液化,相当于减少生成物浓度,平衡向正反应方向进行,有利于氨的生成,符合勒夏特列原理,故B不符合题意;
C、因为反应前后气体系数之和相等,因此增大压强,平衡不移动,增大压强,缩小容器的体积,组分浓度增大,气体颜色加深,不符合勒夏特列原理,故C符合题意;
D、NO2中存在2NO2![]() N2O4,先压缩,气体浓度增大,气体颜色加深,增大压强,平衡向正反应方向进行,气体颜色变浅,符合勒夏特列原理,故D不符合题意;
N2O4,先压缩,气体浓度增大,气体颜色加深,增大压强,平衡向正反应方向进行,气体颜色变浅,符合勒夏特列原理,故D不符合题意;
答案为C。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向物质的量浓度相等的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
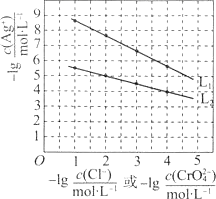
A.Ksp(AgCl)的数量级为10-12
B.L1为Na2CrO4溶液中滴加AgNO3溶液时离子浓度关系曲线
C.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4作指示剂
D.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子水解的方程式中正确的是。
A.NH4Cl溶液在重水(D2O)中水解:NH4++D2O ![]() NH3HDO+D+
NH3HDO+D+
B.![]() 溶液:
溶液:![]()
![]() HPO42-+H3O+
HPO42-+H3O+
C.![]() 溶液:
溶液:![]()
![]() H2CO3+2OH-
H2CO3+2OH-
D.![]() 溶液:
溶液:![]() =Fe(OH)3↓+3H+
=Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
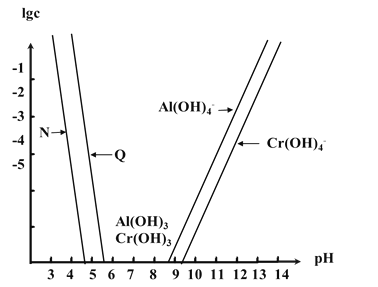
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生。下列说法不正确的是
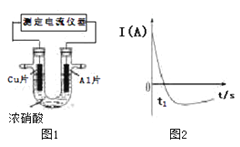
A. 0-t1时,正极的电极反应式为:2H++ NO3- - e-=NO2+ H2O
B. 0-t1时,溶液中的H+ 向Cu电极移动
C. t1时,负极的电极反应式为:Cu–2e-= Cu2+
D. t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用脆硫铅锑矿(主要成分为Pb4FeSb6S14)制取锑白(Sb2O3)的湿法冶炼工艺流程如下图所示。

已知:①锑(Sb)为ⅤA族元素,Sb2O3为两性氧化物;
②“水解”时锑元素转化为SbOCl沉淀;
③Ksp[Fe(OH)2]=8.0×10-16 mol3·L-3,Ksp[Fe(OH)3]=4.0×10-38mol4·L-4
回答下列问题:
(1)“氯化浸出”后的滤液中含有两种锑的氯化物,分别为SbCl3和___________(填化学式)。滤渣ⅰ中所含的反应产物有PbCl2和一种单质,该单质是___________。
(2)“还原”是用锑粉还原高价金属离子。其中,Sb将Fe3+转化为Fe2+的离子方程式为__________,该转化有利于“水解”时锑铁分离,理由是_________。
(3)“还原”用的Sb可由以下方法制得:用Na2S—NaOH溶液浸取辉锑精矿(Sb2S3),将其转化为Na3SbS3(硫代亚锑酸钠)—NaOH溶液。按下图所示装置电解后,阴极上得到Sb,阴极区溶液重新返回浸取作业,阴极的电极反应式为______。该装置中,隔膜是________(填“阳”或“阴”)离子交换膜。
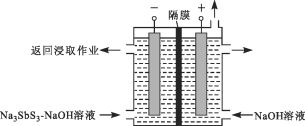
(4)“中和”时若用NaOH溶液代替氨水,Sb2O3可能会转化为____________(填离子符号),使锑白的产量降低。
(5)锑白也可用火法冶炼脆硫铅锑矿制取,该法中有焙烧、烧结、还原和吹炼等生产环节。与火法冶炼相比,湿法冶炼的优点有____________(任写一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com