
����Ŀ��A��B��C��D�ǰ�ԭ��������С�������еĵڶ���������Ԫ�صĵ��ʡ�B��E��Ϊ��ɿ����ijɷ֡�������F����ɫ��Ӧ�ʻ�ɫ����G�У��ǽ���Ԫ�������Ԫ�ص�ԭ�Ӹ�����Ϊ1��2����һ�������£�������֮����ת����ϵ����ͼ(ͼ�в��ֲ���δ�г�)��

����д���пհף�
��1��A��C�ֱ���_______________��
��2��H�����ᷴӦ����E�Ļ�ѧ����ʽ��_____________________________________________��
��3��E��F��Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
��4��F��ˮ��Ӧ�����ӷ���ʽ��____________________________________________________��
��5������E�ĽṹʽΪ��_____________������A-H���������ӻ������ǣ�_____________��
���𰸡� ̼���� Na2CO3 + 2HCl��2NaCl + H2O + CO2�� 2Na2O2 + 2CO2��2Na2CO3 + O2 2Na2O2 + 2H2O��4Na+ +4OH- + O2�� O=C=O Na2O2 ��Na2S ��Na2CO3
��������A��B��C��D�ǰ�ԭ��������С�������еĵڶ���������Ԫ�صĵ��ʣ�B��E��Ϊ��ɿ����ijɷ֣�����B��C��Ӧ�õ�F��F����ɫ��Ӧ�ʻ�ɫ��˵��F���ƵĻ������CΪNa������BΪO2��E��CO2����FΪNa2O2��H��Na2CO3��AΪ̼��G�ǵ���C��D���϶��ɣ�ԭ�Ӹ�����ΪD��C=1��2����G��DԪ��Ϊ-2�ۣ���ԭ������D��C����DΪ��GΪNa2S����
��1�������Ϸ�����֪��AΪ̼��CΪ�����ƣ���2��H��Na2CO3�������ᷴӦ���ɶ�����̼��ˮ����Ӧ�ķ���ʽΪNa2CO3+2HCl��2NaCl+H2O+CO2������3��E��F��ӦΪCO2��Na2O2�ķ�Ӧ������̼���ƺ���������Ӧ�Ļ�ѧ����ʽΪ2CO2+2Na2O2��2Na2CO3+O2����4������������ˮ��Ӧ����������������������ʽΪ2Na2O2+2H2O��4Na++4OH- +O2������5��������̼�Ľṹ��ʽΪO=C=O���������Ӽ��Ļ����������ӻ�������������ӻ��������Na2O2 ��Na2S ��Na2CO3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������500mLŨ��Ϊ2mol/L��NaOH��Һ��ѡ������ƿ�Ĺ�������NaOH�������ֱ�Ϊ��������
A.100 mL ����ƿ��40 g
B.500 mL ����ƿ��40 g
C.100 mL ����ƿ��80 g
D.500 mL ����ƿ��80 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������������Ӧ�ù㷺��
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ������Ӧ��2N2(g)��6H2O��1��![]() 4NH3(g)��3O2(g)
4NH3(g)��3O2(g) ![]() H=��1530 kJ��mol-1����֪��H2O(g) = H2O��1��
H=��1530 kJ��mol-1����֪��H2O(g) = H2O��1�� ![]() H=��44.0 kJ��mol-1����4NH3(g)��3O2(g)
H=��44.0 kJ��mol-1����4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g)
2N2(g)��6H2O(g) ![]() H =_____kJ��mol-1���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____��������ĸ��
H =_____kJ��mol-1���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____��������ĸ��
A����ƽ�������г���Ar B����ƽ�������г���O2
C�����ø��õĴ��� D�����ͷ�Ӧ���¶�
��2�����ð�����ȡ����[CO(NH2)]�ķ�ӦΪ��2NH3(g)��CO2(g)![]() CO(NH2)2(s)��H2O(g)��H��0��ij�¶��£�������Ϊ1L���ܱ�������ͨ��4 mol NH3��2molCO2���÷�Ӧ���е�40sʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯���ߡ�_______________��
CO(NH2)2(s)��H2O(g)��H��0��ij�¶��£�������Ϊ1L���ܱ�������ͨ��4 mol NH3��2molCO2���÷�Ӧ���е�40sʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯���ߡ�_______________��
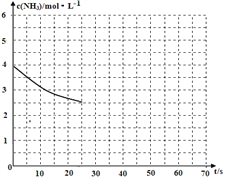
�� �������¶Ⱥ�����������䣬��ƽ����ϵ����ͨ��2molNH3��2molH2O����ʱv��______v�����>������=����<����
��3����������(NaN3)������������ȫ�����У���ҵ ����NaN3��Ҫ����175��ʱ��NaNO3��ĩ�ӵ��ۻ���NaNH2�У�����������ֳ����ļ������ʣ���д���������̵Ļ�ѧ����ʽ_______________________��
��4���ǰ�NH2OH���Կ�����NH3�����ڵ�һ����ԭ�ӱ��ǻ�ȡ��������������ᡢ����ˮ��Һ������ʽ��е�⣬�ڹ��缫��NO3-��ת��ΪNH2OH���Բ�Ϊ��һ������õ�ⷴӦ���ܻ�ѧ����ʽ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H2��O2��ȼ�շ�Ӧ����������ȷ���ǣ�������
A.�÷�Ӧ���ڷ��ȷ�Ӧ
B.�Ͽ�H��H���ų�����
C.�γ�O��H����������
D.��Ӧ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Դ�������Դ����Ϊ����Դ�������������й�����Դ��������ȷ����
A.��ʯȼ���ǿ�������ԴB.���ܡ�̫�����������Դ
C.��ʯȼ�϶��������ԴD.�����ܡ��������Dz��������������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��Q��R��Ϊǰ20��Ԫ�أ���ԭ�Ӱ뾶����Ҫ���ϼ۵Ĺ�ϵ��ͼ��ʾ������˵��������

A. Qλ�ڵ�������IA��
B. X��Y��Z����Ԫ����ɵĻ�����������λ��
C. �����Ӱ뾶��M->Q+>R2+
D. Z��M������������Ӧˮ�����Ϊǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���䲿���Ϻ����������л��������ͳ�ϵ�������������ʽ�������������Ͷ�ܵ�����ʽ���ⲢͶ��ʹ�á�þ��ˮ��ؿ�Ϊ�����ṩ��Դ����װ����ͼ��ʾ�������й�þ��ˮ��ص�˵����ȷ����
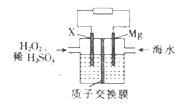
A. Mg�缫�Ϸ�����ԭ��Ӧ
B. �õ�ع���һ��ʱ��������Һ��������
C. �����ĵ缫��ӦʽΪH2O2+2e-+2H+=2H2O
D. ����ع���ʱת��2 mol���ӣ�����2 mol H+�����ӽ���Ĥ������Ҳ�Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��Ϊ�˼���Ũ������ľ̿�ڼ��������·�Ӧ������SO2��CO2���壬�������ͼ��ʾʵ��װ�ã�a��b��cΪֹˮ�У�B�����ڴ��������ң�D�з�����I2�͵��۵���ɫ��Һ��ʪ����֬�ޣ� 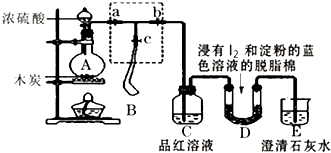
��1��װ��A��ʢ��Ũ������������� ��
��2��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ��ʱ��װ��C�е�����Ϊ ��
��4����ʵ��ɰܵĹؼ����ڿ��Ʒ�Ӧ������������ʲ��ܹ��죬����������ֵ�װ�ã�����ȷ�IJ���˳�������ò��������д���� ����Aװ���м���Ũ���ᣬ���ȣ�ʹA�в����������������B���������г���һ��������ʱ��ֹͣ���ȣ�
�ڴ�װ��A��ȴ��������B��������ٱ仯�ر�ֹˮ��a����ֹˮ��b��������ѹ���ң�ʹ����B��������������װ��C�У����ﵽʵ��Ŀ�ĺر�ֹˮ��b��
�۴�ֹˮ��a��c���ر�ֹˮ��b��
��5����D�в�������ʱ������˵��ʹE�г���ʯ��ˮ����ǵ���CO2 �� ������SO2��д��D�з�����Ӧ�Ļ�ѧ����ʽ �� ��D�з�Ӧ����0.3mol����ת��ʱ��������Ӧ��������������״������L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤�������Ѿ���ȫˮ����Լ��ǣ�������
A.���۩��⻯����ֽ
B.������Һ
C.��ˮ
D.�⻯��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com