
����Ŀ��ij����С��Ϊ�˼���Ũ������ľ̿�ڼ��������·�Ӧ������SO2��CO2���壬�������ͼ��ʾʵ��װ�ã�a��b��cΪֹˮ�У�B�����ڴ��������ң�D�з�����I2�͵��۵���ɫ��Һ��ʪ����֬�ޣ� 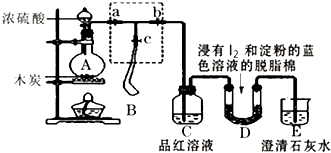
��1��װ��A��ʢ��Ũ������������� ��
��2��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ��ʱ��װ��C�е�����Ϊ ��
��4����ʵ��ɰܵĹؼ����ڿ��Ʒ�Ӧ������������ʲ��ܹ��죬����������ֵ�װ�ã�����ȷ�IJ���˳�������ò��������д���� ����Aװ���м���Ũ���ᣬ���ȣ�ʹA�в����������������B���������г���һ��������ʱ��ֹͣ���ȣ�
�ڴ�װ��A��ȴ��������B��������ٱ仯�ر�ֹˮ��a����ֹˮ��b��������ѹ���ң�ʹ����B��������������װ��C�У����ﵽʵ��Ŀ�ĺر�ֹˮ��b��
�۴�ֹˮ��a��c���ر�ֹˮ��b��
��5����D�в�������ʱ������˵��ʹE�г���ʯ��ˮ����ǵ���CO2 �� ������SO2��д��D�з�����Ӧ�Ļ�ѧ����ʽ �� ��D�з�Ӧ����0.3mol����ת��ʱ��������Ӧ��������������״������L��
���𰸡�
��1����Һ©��
��2��C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O
CO2��+2SO2��+2H2O
��3��Ʒ����Һ��ɫ
��4���ۢ٢�
��5��������һ����֬����ɫ��dz��������һ����֬����ɫ���䣻I2+SO2+2H2O=H2SO4+2HI��3.36
���������⣺��1��װ��A��ʢ��Ũ�������������Ϊ��Һ©�������Դ��ǣ���Һ©������2��װ��A��Ũ������ǿ�����ԣ��ܽ�C����Ϊ������̼����Ӧ�Ļ�ѧ����ʽΪC+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ��
CO2��+2SO2��+2H2O�����Դ��ǣ�C+2H2SO4��Ũ�� ![]() CO2��+2SO2��+2H2O����3�������������Ư���ԣ�����C��Ʒ����Һ��ɫ�����Դ��ǣ�Ʒ����Һ��ɫ����4������B���������ռ����壬Ҫ��������٣������߿����������Ӧ���ռ����壬Ȼ���������ͷ����壬������ȷ�IJ���˳��Ϊ���ۢ٢ڣ����Դ��ǣ��ۢ٢ڣ���5����Dװ���н�����һ����֬����ɫ��dz��������һ����֬����ɫ����ʱ�������ڳ����Ƕ�����̼���ⵥ���ܽ�������������Ϊ���ᣬ��Ӧ�Ļ�ѧ����ʽΪ��I2+SO2+2H2O=H2SO4+2HI����Ӧ�е���ת��2e��������Ӧ����������������ʵ���Ϊ1mol����D�з�Ӧ����0.3mol����ת��ʱ��������Ӧ����������ʵ���=0.15mol���������״����=22.4L/mol��0.15mol=3.36L�����Դ��ǣ�������һ����֬����ɫ��dz��������һ����֬����ɫ���䣻I2+SO2+2H2O=H2SO4+2HI�� 3.36��
CO2��+2SO2��+2H2O����3�������������Ư���ԣ�����C��Ʒ����Һ��ɫ�����Դ��ǣ�Ʒ����Һ��ɫ����4������B���������ռ����壬Ҫ��������٣������߿����������Ӧ���ռ����壬Ȼ���������ͷ����壬������ȷ�IJ���˳��Ϊ���ۢ٢ڣ����Դ��ǣ��ۢ٢ڣ���5����Dװ���н�����һ����֬����ɫ��dz��������һ����֬����ɫ����ʱ�������ڳ����Ƕ�����̼���ⵥ���ܽ�������������Ϊ���ᣬ��Ӧ�Ļ�ѧ����ʽΪ��I2+SO2+2H2O=H2SO4+2HI����Ӧ�е���ת��2e��������Ӧ����������������ʵ���Ϊ1mol����D�з�Ӧ����0.3mol����ת��ʱ��������Ӧ����������ʵ���=0.15mol���������״����=22.4L/mol��0.15mol=3.36L�����Դ��ǣ�������һ����֬����ɫ��dz��������һ����֬����ɫ���䣻I2+SO2+2H2O=H2SO4+2HI�� 3.36��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2FeBr2��3Cl2===2FeCl3��2Br2�ķ�Ӧ�У���������Ԫ����(����)
A. Fe B. Fe��Br C. Cl D. Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�ǰ�ԭ��������С�������еĵڶ���������Ԫ�صĵ��ʡ�B��E��Ϊ��ɿ����ijɷ֡�������F����ɫ��Ӧ�ʻ�ɫ����G�У��ǽ���Ԫ�������Ԫ�ص�ԭ�Ӹ�����Ϊ1��2����һ�������£�������֮����ת����ϵ����ͼ(ͼ�в��ֲ���δ�г�)��

����д���пհף�
��1��A��C�ֱ���_______________��
��2��H�����ᷴӦ����E�Ļ�ѧ����ʽ��_____________________________________________��
��3��E��F��Ӧ�Ļ�ѧ����ʽ��_____________________________________________________��
��4��F��ˮ��Ӧ�����ӷ���ʽ��____________________________________________________��
��5������E�ĽṹʽΪ��_____________������A-H���������ӻ������ǣ�_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڽ����к��ȵIJⶨ�У����в���������ǣ�������
A.��Ӧǰ�ᡢ����Һ���¶�Ҫ��ͬ
B.������Һ���¶ȼ�Ҫһֱ������Һ��
C.Ϊ��ʹ��Ӧ���Ƚ��У��������ᣨ��зִμ����ᣩ
D.Ϊ��ʹ��Ӧ����ȫ������ʹ�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ�����л�����й���Ϣ�����ݱ�����Ϣ�ش����⣮
A | B | C |
�������������һ�����ҵ�ʯ�ͻ���ˮƽ | ����ģ��Ϊ�� | ������Ҫ�ɷ� |
��1��A�ṹ��ʽ�� �� ��������ʹ���Ը��������Һ��������Ȼ�̼��Һ��ɫ�����У����������ܷ����ķ�Ӧ�����Ӧ���ͣ������巴Ӧ�Ļ�ѧ����ʽΪ �� ��������Ȼ�̼��Һ��������2.8gʱ�������������Ϊ ��
��2����ҵ�ϣ�B��Դ��ú������Һ̬����ú���ͣ�B��Ũ���ᷢ��ȡ����Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��C��������Ӧ�����ɶ��ȴ����д���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������������̽��SO2�����ʣ�ʵ��ʱ��Na2SO3�����ϵμ���Ũ���ᣬ��������һ����������档���ж�ʵ���������������Ͳ���ȷ����

ѡ�� | ʵ������ | ���� |
A | BaCl2��Һ����� | SO2��BaCl2��Һ��Ӧ������BaSO3���� |
B | Na2S��Һ����� | SO2��Na2S��Һ��Ӧ������S���� |
C | ����KMnO4��Һ��ɫ | SO2���л�ԭ�� |
D | Ʒ����Һ��ɫ | SO2����Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ���ȡ�Ķ����ڵ�һ���֣�����Ԫ�ؾ�����ϡ������Ԫ�ء����й���������Ԫ�ؼ��仯�����˵������ȷ���� ( )
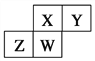
A. ԭ�Ӱ뾶��W>Z>Y>X
B. ��̬�⻯����ȶ��ԣ�Z>W>X>Y
C. W����������ϼ��븺���ϼ۵ľ���ֵһ�������
D. Z������������ˮ�������Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100 mL 3mol/L��NH4Cl��Һ��50 mL2 mol/L��CaCl2��Һ�������ӵ����ʵ���Ũ��֮��Ϊ
A. 3��2 B. 3��1 C. 3��4 D. 1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ�������������ͼ1�� 
��1�����ϳɡ�������Եõ�ClO2 �� �䷴Ӧ�Ļ�ѧ����ʽΪ ��
��2������⡱��������������һ�����壬�仯ѧʽΪ ��
��3����Ӧ���ɵ�ClO2�����ڸ�Ч�ѳ������е�SO2 �� ��ClO2�ѳ�SO2ʵ��ʱSO2�ѳ�������ҺpH��ϵ��ͼ2��ʾ��pH��3��7.6֮��ʱ����pH����ClO2�����Լ����������ʽ��ͣ�����pH��7.6ʱ����pH����SO2�ѳ��������ߣ���ԭ�����Ϊ ��
��4�����ұ��涨��Ʒ���ż����Լ����ȡ�99.8%���������Լ����ȡ�99.7%����ѧ���Լ����ȡ�99.5%��Ϊ��ȷ��ij����NaClO2��Ʒ�ĵȼ����о�С����Ʋⶨ�������£�ȡ10.00g��Ʒ������������ˮ�ܽ�����Թ�����KI��Һ����ַ�Ӧ����ӦҺ������200mL��ȡ��20.00mL����ƿ������ƿ�еμ����ε�����Һ����2.00molL��1��Na2S2O3��Һ��֮��Ӧ������Na2S2O3��Һ22.00mL������Ʒ�ɴ��Լ����ȣ���д��������̣� ��֪��ClO2��+4I��+4H+�T2H2O+2I2+Cl�� �� I2+2S2O32���T2I��+S4O62�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com