
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如图1: 
(1)“合成”步骤可以得到ClO2 , 其反应的化学方程式为 .
(2)“电解”步骤阳极会生成一种气体,其化学式为 .
(3)反应生成的ClO2可用于高效脱除烟气中的SO2 . 以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如图2所示.pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低.而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为 .
(4)国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%.为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200mL,取出20.00mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00molL﹣1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00mL.该样品可达试剂纯度.(写出计算过程) 已知:ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣ , I2+2S2O32﹣═2I﹣+S4O62﹣ .
【答案】
(1)2NaClO3+SO2+H2SO4═2NaHSO4+2ClO2
(2)Cl2
(3)碱性条件下OH﹣吸收SO2
(4)化学纯
【解析】解:(1)“反应”步骤中生成ClO2的化学方程式为2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;所以答案是:2NaClO3+SO2+H2SO4═2NaHSO4+2ClO2;(2)由分析可知,阳极Cl﹣失电子生成Cl2;所以答案是:Cl2;(3)碱性条件下OH﹣吸收SO2 , 与ClO2反应的SO2增多,SO2脱除率又升高; 所以答案是:碱性条件下OH﹣吸收SO2;(4)n(Na2S2O3)=2.00molL﹣1×22×10﹣3L=4.4×10﹣2mol
NaClO2 … | 4Na2S2O3 |
1 | 4 |
n(NaClO2) | 4.4×10﹣2mol |
n(NaClO2)=1.1×10﹣2mol
ω(NaClO2)= ![]() ×100%=99.55%
×100%=99.55%
产品达到化学纯度;该样品达到化学纯试剂纯度.


科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉. 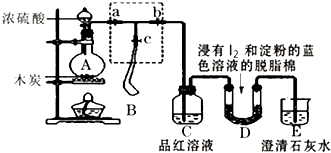
(1)装置A中盛放浓硫酸的仪器名称 .
(2)装置A中发生反应的化学方程式为 .
(3)实验时,装置C中的现象为 .
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写). ①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(5)当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式 , 当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产生活和科学研究中具有重要的作用。下列说法正确的是( )
①耐高温的碳化硅陶瓷是新型无机非金属材料
②现代建筑物大量使用的玻璃和水泥都是硅酸盐材料
③单质硅可以用来制造太阳能电池
④水晶项链和陶瓷都是硅酸盐材料
A.①②③B.②③④C.①②④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是一种单糖,其主要原因解释正确的是( )
A.分子结构最简单
B.在糖类物质中含碳原子最少
C.不能水解生成更简单的糖
D.分子中含有一个醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如以下左图所示。

根据判断出的元素回答问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________,B的分子式为_________。
(2)比较e、f离子的半径大小(用元素离子符号表示)__________________;非金属性g_____h(填“强于”或“弱于”),用一个化学方程式证明你的推论 ________。
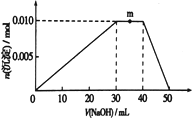
(3)上述元素可组成盐R【化学式为zx4f(gd4)2】,向盛有10mL1mol·L1R溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如以上右图:
①上述NaOH溶液物质的量的浓度为_________________________。
②写出m点反应的离子方程式______________________________。
③若向R溶液中改加20mL1.1mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com