
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
【答案】 a ab cd 正 Fe-2e-=Fe2+ Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O 5
【解析】I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4。
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故选a;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去,故选ab;通过钠离子交换树脂,除去Ca2+和Mg2+,故选cd,故答案为:ab;cd;
II.(3)根据题意,用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3,则阴极发生氢离子的放电生成氢气,阳极铁失去电子生成亚铁离子,生成的亚铁离子被Cr2O72-氧化,因此电解时连接铁棒的一极是电源的正极,故答案为:正;
(4)根据上述分析,电解时阳极的电极反应式为Fe-2e-=Fe2+;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O,故答案为:Fe-2e-=Fe2+;Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O;
(5)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() =10-9 mol/L,c(H+)═
=10-9 mol/L,c(H+)═![]() =10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。


科目:高中化学 来源: 题型:
【题目】以下为三种有机物的有关信息,根据表中信息回答问题.
A | B | C |
其产量用来衡量一个国家的石油化工水平 | 比例模型为: | 沼气主要成分 |
(1)A结构简式是 . 该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色.其中,与高锰酸钾溶发生的反应是(填反应类型);与溴反应的化学方程式为 , 当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为 .
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为 .
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列一组图示的说法中正确的是( ) 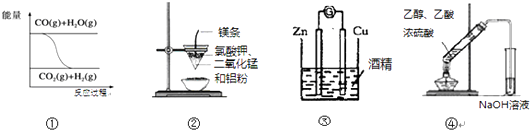
A.图①表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)”为吸热反应
B.图②可以制取金属锰
C.图③形成原电池
D.图④制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
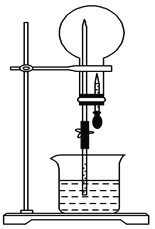
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
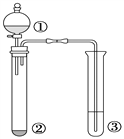
选项 | ① | ② | ③ | 实验结论 |
A | 80%硫酸溶液 | Na2SO3 | 酸性高锰酸钾溶液 | SO2有漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如图1: 
(1)“合成”步骤可以得到ClO2 , 其反应的化学方程式为 .
(2)“电解”步骤阳极会生成一种气体,其化学式为 .
(3)反应生成的ClO2可用于高效脱除烟气中的SO2 . 以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如图2所示.pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低.而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为 .
(4)国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%.为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200mL,取出20.00mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00molL﹣1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00mL.该样品可达试剂纯度.(写出计算过程) 已知:ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣ , I2+2S2O32﹣═2I﹣+S4O62﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”. ①目前我国空气质量检测体系包括:PM2.5、SO2、NO2、O3、CO等指标.其中被认为是引起雾霾天气的元凶;会引起硫酸型酸雨的气体为 .
②NH3催化还原氮氧化合物转化为无污染物质是目前应用最广泛的烟气氮氧化合物脱除技术,写出NH3催化还原NO2反应的化学方程式 .
③减少CO2的排放对于环境保护具有重要意义.在海洋碳循环中,可通 过图3所示的途径固碳.写出钙化作用的离子方程式: . 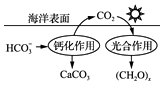
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A. a点时溶液中发生的反应为:Fe+2Fe3+=3Fe2+
B. b点时溶液中固体剩余物为Fe和Cu
C. c点时溶液中溶质的物质的量浓度为0.25 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com