
【题目】2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”. ①目前我国空气质量检测体系包括:PM2.5、SO2、NO2、O3、CO等指标.其中被认为是引起雾霾天气的元凶;会引起硫酸型酸雨的气体为 .
②NH3催化还原氮氧化合物转化为无污染物质是目前应用最广泛的烟气氮氧化合物脱除技术,写出NH3催化还原NO2反应的化学方程式 .
③减少CO2的排放对于环境保护具有重要意义.在海洋碳循环中,可通 过图3所示的途径固碳.写出钙化作用的离子方程式: . 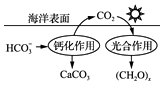
【答案】PM2.5;SO2;8NH3+6NO2 ![]() 7N2+12H2O;Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O
7N2+12H2O;Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O
【解析】解:①PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物,对雾霾天气的形成有促进作用、雾霾天气又能进一步加剧其积聚,所以PM2.5被认为是引起雾霾天气的元凶;SO2和NO2能与水反应生成酸,能引起酸雨,SO2与水反应生成亚硫酸,亚硫酸与氧气反应生成硫酸,所以会引起硫酸型酸雨的气体为SO2;所以答案是:PM2.5;SO2;②NH3催化还原NO2生成氮气和水,反应的方程式为:8NH3+6NO2 ![]() 7N2+12H2O;所以答案是:8NH3+6NO2
7N2+12H2O;所以答案是:8NH3+6NO2 ![]() 7N2+12H2O;③碳酸氢根离子与钙离子反应生成碳酸钙和二氧化碳、水,钙化作用的离子方程式为:Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O; 所以答案是:Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O.
7N2+12H2O;③碳酸氢根离子与钙离子反应生成碳酸钙和二氧化碳、水,钙化作用的离子方程式为:Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O; 所以答案是:Ca2++2HCO3﹣═CaCO3↓+CO2↑+H2O.


科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3 + 3ClO- + 4OH-=2RO4n- + 3Cl- + 5H2O,则RO4n-中R的化合价是
A.+6B.+5C.+4D.+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3 mol氧气和0.2 mol臭氧(O3)的
A. 分子数相等 B. 体积相等
C. 标准状况下体积比是2:3 D. 标准状况下的体积比是3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西兰花营养丰富,含蛋白质、淀粉、油脂、叶酸、维生素C和叶绿素,营养成份位居同类蔬菜之首,被誉为“蔬菜皇冠”. ①维生素C俗名为 . 在一支盛有2mL 2%淀粉溶液的试管中滴入2滴碘水,溶液呈蓝色,再滴入维生素C的水溶液,溶液颜色变为 , 该实验说明维生素C具有性.
②油脂在人体内水解的最终产物是(写名称)和甘油.
③西兰花成分中可做天然着色剂的是 , 属于糖类的是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如以下左图所示。

根据判断出的元素回答问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________,B的分子式为_________。
(2)比较e、f离子的半径大小(用元素离子符号表示)__________________;非金属性g_____h(填“强于”或“弱于”),用一个化学方程式证明你的推论 ________。
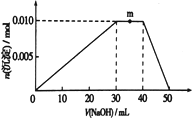
(3)上述元素可组成盐R【化学式为zx4f(gd4)2】,向盛有10mL1mol·L1R溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如以上右图:
①上述NaOH溶液物质的量的浓度为_________________________。
②写出m点反应的离子方程式______________________________。
③若向R溶液中改加20mL1.1mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com