
【题目】0.3 mol氧气和0.2 mol臭氧(O3)的
A. 分子数相等 B. 体积相等
C. 标准状况下体积比是2:3 D. 标准状况下的体积比是3:2
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:_______,Y元素在元素周期表中的位置_____________,Z元素的原子结构示意图____________。
(2)Y2X对应水化物的电子式____________,其中存在的化学键有____________。
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因___________________。
(4)用电子式表示Y2X的形成过程:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标况下,22.4L的SO3分子含硫原子的数目为NA
B. 常温常压下,200g质量分数为17%的H2O2溶液中含氧原子数目为NA
C. 7.1g氯气与足量NaOH溶液反应制备漂白液转移电子数为0.1NA
D. 1.8g的D2O含有NA个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列一组图示的说法中正确的是( ) 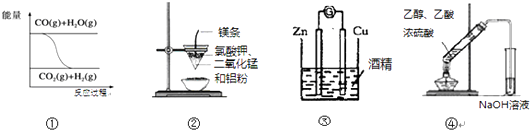
A.图①表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)”为吸热反应
B.图②可以制取金属锰
C.图③形成原电池
D.图④制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生反应(填“氧化”或“还原”);溶液中的H+移向(填“正极”或“负极”).若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质变质量为47g,试计算产生氢气的体积(标准状况) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,然后打开止水夹,下列与实验事实相符的是
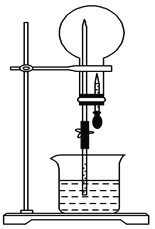
A. NH3(H2O含紫色石蕊试液),红色喷泉
B. SO2(NaOH溶液),无色喷泉
C. HCl(H2O含紫色石蕊试液),蓝色喷泉
D. NO(NaOH溶液),无色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,能得出相应实验结论的是
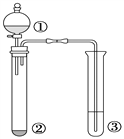
选项 | ① | ② | ③ | 实验结论 |
A | 80%硫酸溶液 | Na2SO3 | 酸性高锰酸钾溶液 | SO2有漂白性 |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可生成白色沉淀 |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月4日,G20峰会召开,扬州天空呈现出干净的蓝色,云彩随意地铺散在天空,纯净透明,出现了持续的“水晶天”. ①目前我国空气质量检测体系包括:PM2.5、SO2、NO2、O3、CO等指标.其中被认为是引起雾霾天气的元凶;会引起硫酸型酸雨的气体为 .
②NH3催化还原氮氧化合物转化为无污染物质是目前应用最广泛的烟气氮氧化合物脱除技术,写出NH3催化还原NO2反应的化学方程式 .
③减少CO2的排放对于环境保护具有重要意义.在海洋碳循环中,可通 过图3所示的途径固碳.写出钙化作用的离子方程式: . 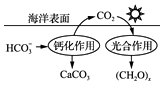
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com