
����Ŀ�������������������´ɡ��մɡ������������ϵ���ɫ�����ɸ�̼�����Ͻ𣨺�Cr��Fe��C���Ʊ������������Ĺ����������£�

��֪��Cr(OH)3���������������������Ϊ���
�ش��������⣺
��1����������ȡʱ��Ϊ��߽�ȡ���ʣ�������̼�����Ͻ��Ƴɷ�ĩ�⣬���ɲ�ȡ�Ĵ�ʩ��__________________________��дһ�㣩����ȡ��ʱ��Ӧ�����ӷ���ʽΪ_______________��
��2�����������������ٴν�ȡ��Ŀ����_____________________________________________��
��3������������ʱ����Һ��pH������ȥ����Ӱ����ͼ1��ʾ��

ͼ1 ͼ2
pHС��2.3ʱ����ȥ���ʵͣ���ԭ����_______________________________________��
��4����������˵��������ϴ�Ӹɾ��IJ�����________________________________________��
��5������������ʱ������Cr(OH)3�Ļ�ѧ����ʽΪ_____________________________������ʱ����ҺpH����Ļ����ʹ�ϵ��ͼ2��ʾ����pH��8.5ʱ��pHԽ���Ļ�����Խ�ͣ������ԭ����____________________________________________��
���𰸡� �ʵ���������Ũ�Ȼ��ʵ���߽�ȡҺ�¶Ȼ���� 2Cr+6H+ ===2Cr3++3H2�� ��߸��Ľ�ȡ�� H2C2O4�������C2O42- Ũ�ȵͣ�������FeC2O4��2H2O���� �����һ��ϴ��Һ�е���BaCl2��Һ���ް�ɫ���� Cr2(SO4)3+6NH4HCO3 ===2Cr(OH)3��+3(NH4)2SO4+6CO2�� Cr(OH)3 ������ǿ���Ե���Һ��
����������1������Ӱ�컯ѧ��Ӧ���ʵ��������ڹ�Һ��Ӧ������ѹǿ�����Կɿ���Ũ�ȡ��¶ȼ��Ӵ�����ȣ����ʵ���������Ũ�Ȼ��ʵ���߽�ȡҺ�¶Ȼ���������������������Ϣ�ɵã�����ȡ���������۸��Ļ�����ʸ�Ӧ���ǽϻ��ý�������ϡ���ᷴӦ��������������������ӷ���ʽΪ��2Cr+6H+ =2Cr3++3H2����
��2����������������ٴν�ȡ����ʹ���е���Ч�ɷ�CrԪ�ر���ֽ�ȡ����߸��Ľ�ȡ����
��3����������ʱ��������ӦΪ��Fe2+ +C2O42- +2H2O![]() FeC2O4��2H2O�����������ᣬH2C2O4
FeC2O4��2H2O�����������ᣬH2C2O4![]() H++HC2O4-��HC2O4-
H++HC2O4-��HC2O4-![]() H++ C2O42-��pHԽС����Һ��H+Ũ��Խ����������룬C2O42- Ũ��С�������ڳ�����Ӧƽ�����ơ�
H++ C2O42-��pHԽС����Һ��H+Ũ��Խ����������룬C2O42- Ũ��С�������ڳ�����Ӧƽ�����ơ�
��4����ȡ��ʹ�õ���ϡ���ᣬ��Ҫ���鲽����ij����Ƿ���ϴ�Ӹɾ������Լ���SO42-�������һ��ϴ��Һ�е���BaCl2��Һ�����ް�ɫ��������˵��������ϴ�Ӹɾ���
��5���������̿ɵã�����֮ǰΪCr2(SO4)3��Һ������NH4HCO3������������Cr(OH)3�⣬��������狀�CO2���ɣ���ѧ����ʽΪ��Cr2(SO4)3+6NH4HCO3=2Cr(OH)3��+3(NH4)2SO4+6CO2��������֪Cr(OH)3������������������ͼ2��ʾ����pH��8.5ʱ��pHԽ���Ļ�����Խ�ͣ�����ΪCr(OH)3������ǿ���Ե���Һ����


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ܿ϶��ж�ij��ѧƽ�ⷢ��ת�Ƶ���
A.��Ӧ������Ũ�ȸı�
B.��Ӧ������и���ֵĺ����ı�
C.�����淴Ӧ���ʸı�
D.��Ӧ���ת���ʸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤��λͬѧ���ж���ȷ����ͬѧ�������ͼ1��ʾʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX�����巢��װ����ȥ�����Իش� 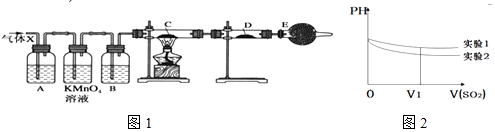
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ ��
��2����ͬѧ��Ϊ�����ܲ��������������� ��
��3��A�м�����Լ������� �� ��������B�м�����Լ������� �� ��������
��4������֤������X�к���������ʵ�������ǣ�C�У� �� D�У� ��
��5��II����С��ͬѧ���ռ���SO2����ͨ��0.1molL��1��Ba��NO3��2��Һ�У��õ���BaSO4������Ϊ̽��������Һ�к�����������ͨ���SO2 �� ��С����������¼��裺 ����һ����Һ�е�NO3��
���������Һ���ܽ��O2
��С�����ʵ����֤�˼���һ��
�����±��հ״���д���ʵ������
ʵ�鲽�� | ʵ������ | ���� |
ʵ��1����ʢ�в���O2��25ml0.1mol/LBaCl2��Һ���ձ��У�����ͨ�봿����SO2���� | ����һ���� | |
ʵ��2����ʢ�в���O2��25ml0.1mol/LBa��NO3��2��Һ���ձ��У�����ͨ�봿����SO2���� |
��6��Ϊ�����о��÷�Ӧ����С�黹�����������ʵ������Һ��pH��ͨ��SO2����ı仯������ͼ2��ʵ��1����ҺpH��С��ԭ����V1ʱ��ʵ��2����ҺpHС��ʵ��1��ԭ���ǣ������ӷ���ʽ��ʾ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ�ֱ�Ӽ���BaCl2��NaCl��Na2CO3������Һ���Լ��ǣ�������
A.AgNO3��ҺB.ϡ����C.ϡ����D.ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ĸ�ҩƷ�����Ѵ������ҩƷ��
�� | �׳� | �ҳ� | ���� | ���� |
ҩƷ | ���ᡢ���� | CCl4��C2H5OH | ���ס��� | ͭ��п |
ʵ�����¹���һЩ����̿��Ӧ���������
A. �׳� B. �ҳ� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴӵ�ˮ����ȡ���ʵ����,����˵����ȷ����(����)
A.��ȡ��Ҫ������ˮ,�ұ�ˮ������ʹ���ܽ�
B.ע���ˮ����ȡ��,��ת��Һ©������������������Һ
C.��ȡ����ʱ,Ӧѡ���л���ȡ��,����ȡ�����ܶȱ����ˮ��
D.ʵ�������û�����Ȼ�̼,�����þƾ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ���
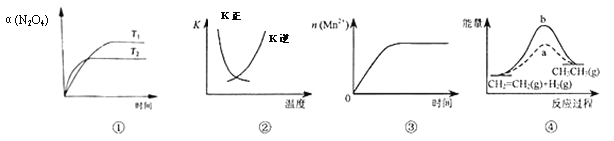
A. ͼ�ٱ�ʾN2O4(g)![]() 2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
2NO2(g) ��H��0��N2O4ת�������¶ȡ�ʱ��ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g)+O2(g)![]() 2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g) ��H��0�������淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ�۱�ʾ10 mL0.01 mol/LKMnO4������Һ�����0.1mol/LH2C2O4��Һ���ʱ��n(Mn2+)��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+H2(g)![]() CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
CH3CH3(g) ��H��0��ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
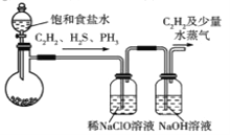
����Ŀ�������ǻ����л��ϳ�ԭ�ϣ��㷺����ҽҩ��ұ��ͻ����Ȳ��š�ijУ����С���ͬѧ��������Ȳ�ϳ�H2C2O4��2H2O���ش���������:
��1�������ͬѧ���õ�ʯ����Ҫ�ɷ�CaC2����CaS��Ca3P2�����ʣ���ȡC2H2[��Ӧ����ʽΪCaC2 +2H2O=Ca(OH)2 +C2H2(g) ��H��0���÷�Ӧ����]��ʵ��װ�����£�
A B C
��װ��A�У�Ϊ��С������Ȳ�����ʣ����ñ���ʳ��ˮ����ˮ�⣬���ɲ�ȡ�Ĵ�ʩ��_____����һ������
��װ��A�У�Ca3P2��ˮ��Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
װ��B�У�NaClO����ԭΪ�Ȼ��ƣ���Ӧ�����л��м�����Cl2���ɡ�д��H2S��NaClO��Һ����Ϊ�������Ҫ��Ӧ�����ӷ���ʽ:___________________________��
��װ�DC��NaOH��Һ��������___________________________________________________��
��2�������ͬѧ���ü�����ȡ����Ȳ��Ũ������Hg(NO3)2���·�Ӧ�������ᾧ���ؽᾧ��H2C2O4��2H2O���Ʊ�װ������:
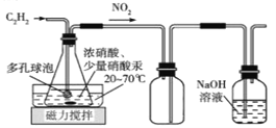
D E F
��װ��D�ж�����ݵ�������___________________________________________��װ��E��������__________________________________________________________��
��װ��D����H2C2O4 ��Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��3�������ͬѧ�����ʵ��֤��������л�ԭ�ԡ���ʵ�鷽��Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�µ�������SO2�����CO2���壬�����йرȽϵ������У���ȷ���Ǣ��ܶȱ�Ϊ16��11 ���ܶȱ�Ϊ11��16 �������Ϊ16��11 �������Ϊ11��16�� ��
A.�٢�
B.�٢�
C.�ڢ�
D.�ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com