
【题目】在周期表中,锗和硅位于同主族。四氯化锗(GeCl4)是光导纤维的掺杂剂,其熔点为-49.5℃, 沸点为83.1℃;易水解,对上呼吸道及皮肤有刺激作用。实验室制备四氯化锗的原理是:Ge+2Cl2=GeCl4。某课题组同学拟选择下列装置设计实验制备四氯化锗(部分加热装置和夹持装置省略)。回答下列问题:
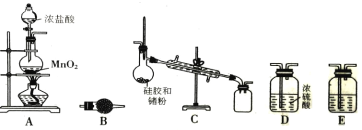
(1)写出A装置中发生反应的化学方程式_______________。
(2)若气体从左到右流动,则装置连接顺序为A、_______________。
(3)C装置中用于冷凝四氯化锗蒸气的仪器名称是_______________,B装置中的试剂是_______________。
(4)E装置中的试剂是_______________,其作用是_______________。
(5)下列有关说法正确的是_______________。
①实验中,先通入氯气,后加热C中烧瓶
②C装置中温度计的温度控制在49℃左右
③观察到D瓶有气泡和液面上有黄绿色气体
④C装置中硅胶的主要作用可能是干燥产品
(6)四氯化锗遇水蒸气产生一种强酸和一种弱酸。实验室用足量NaOH溶液吸收尾气中少量四氯化锗气体,写出该反应的化学方程式:__________________。
(7)实验中消耗m g 纯锗粉制得a g GeCl4,则锗的利用率为_______________(用含 m、a 的代数式表示)。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O E、D、C、B (直形)冷凝管 碱石灰 饱和食盐水 除去氯气中的氯化氢 ①③ GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O
MnCl2+Cl2↑+2H2O E、D、C、B (直形)冷凝管 碱石灰 饱和食盐水 除去氯气中的氯化氢 ①③ GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O ![]() ×100%
×100%
【解析】
(1) 在A装置中浓盐酸与MnO2混合加热制取Cl2;
(2)根据制取的气体中的成分,对气体净化除杂、发生反应制取四氯化锗,同时结合四氯化锗易水解的性质在制取时要避免接触水蒸气分析;
(3)根据仪器结构判断仪器名称;根据装置B中试剂作用判断使用的试剂;
(4)装置E中试剂作用吸收氯气中的杂质HCl,不能反应消耗Cl2;
(5)空气中含有水蒸气,会干扰实验的进行,结合各种物质的性质及装置的作用分析判断;
(6)GeCl4与水反应产生HCl和H2GeO3,然后根据酸碱中和反应原理,书写反应方程式;
(7)根据反应产生GeCl4的质量计算消耗的Ge,然后计算Ge的利用率。
(1)在A装置中浓盐酸与MnO2混合加热制取Cl2,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)实验装置连接顺序为:使用装置A制取Cl2,通过装置E中的饱和食盐水除去Cl2中的杂质HCl、通过装置D干燥氯气、然后在装置C中反应产生GeCl4、最后用装置B进行尾气处理,故若气体按照从左到右流动,则装置连接顺序为A、E、D、C、B;
(3)根据装置图可知:C装置中用于冷凝四氯化锗蒸气的仪器名称是(直形)冷凝管;B装置的作用是吸收未反应的氯气、防止污染空气,并防止外界空气中的水蒸气进入C装置中,即同时起干燥作用,可选择使用碱石灰;
(4)装置E的作用是用于除去Cl2中的杂质HCl,同时不能反应消耗Cl2,可根据Cl2与水反应是可逆反应,根据平衡移动原理,使用饱和NaCl溶液除去Cl2中的杂质HCl;
(5)①实验中,先通入氯气,后加热C中烧瓶可排出装置中的空气,避免空气中的氧气与锗粉反应产生氧化锗,同时也可以防止空气中的水蒸气与反应产生的GeCl4发生水解作用, ①正确;
②GeCl4的沸点是83.1℃,故C装置中温度计的温度要控制略高于83.1℃,②错误;
③浓硫酸的作用是干燥氯气,因此会观察到D瓶有气泡和液面上有黄绿色气体,③正确;
④硅胶是多孔状物质,可作反应的载体,能增大锗粉与氯气反应的接触面积,而不是作干燥剂,且反应产生四氯化锗产品时没有生成水,④错误;
故合理选项是①③;
(6)四氯化锗与NaOH溶液反应分两步进行,首先是四氯化锗与溶液中的水反应产生HCl和H2GeO3,GeCl4+3H2O=4HCl+H2GeO3,然后是反应得到的两种酸分别与NaOH发生中和反应:HCl+NaOH=NaCl+H2O;H2GeO3+2NaOH=Na2GeO3+2H2O,反应的总方程式为:GeCl4+6NaOH=Na2GeO3+4NaCl+3H2O;
(7)m g锗粉的物质的量是n(Ge)=![]() mol,实际上产生GeCl4质量是a g,a g GeCl4的物质的量是n(GeCl4)=
mol,实际上产生GeCl4质量是a g,a g GeCl4的物质的量是n(GeCl4)=![]() mol,根据Ge元素守恒,消耗Ge的物质的量为n(Ge)=
mol,根据Ge元素守恒,消耗Ge的物质的量为n(Ge)=![]() mol,则Ge的利用率为:
mol,则Ge的利用率为: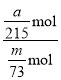 ×100%=
×100%=![]() ×100%。
×100%。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物Y可发生重排反应:
 (X)
(X)![]()
 (Y)
(Y)![]()
 (Z)
(Z)
下列说法不正确的是
A.X、Y、Z互为同分异构体
B.1mol X最多能与3molH2发生加成反应
C.1mol Y最多能与2molNaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列4种重要的有机物:
①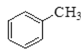 ②
②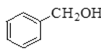 ③
③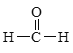 ④
④![]()
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2OHCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的降血糖药物M(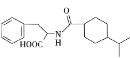 )的合成路线如下(略去部分反应条件):
)的合成路线如下(略去部分反应条件):
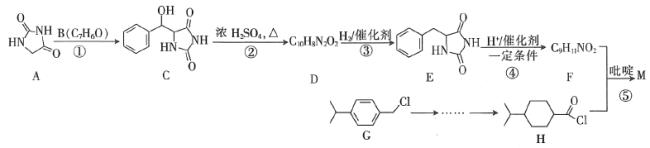
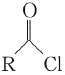
已知: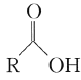
![]()
回答下列问题:
(1)B的名称为________,F的结构简式为________。
(2)反应②的反应类型为________。
(3)下列关于上述涉及的有机物的说法正确的是________(填标号)。
a.化合物E能使酸性高锰酸钾溶液褪色
b.化合物F既能与盐酸反应,又能与![]() 溶液反应
溶液反应
c.M中含氧官能团的名称为酯基、酮基
(4)写出![]() 的化学方程式:________。
的化学方程式:________。
(5)由G可制得物质I(![]() ),写出满足下列条件的I的同分异构体的结构简式:________。
),写出满足下列条件的I的同分异构体的结构简式:________。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②除苯环外不含其他环
③![]() 谱中峰面积之比为
谱中峰面积之比为![]()
(6)请设计以G为原料合成H的合理路线流程图(无机试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是
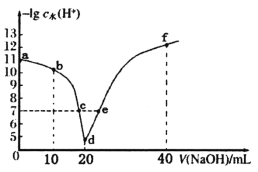
A.从a到d,HA的电离先促进再抑制
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
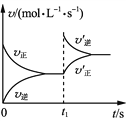
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
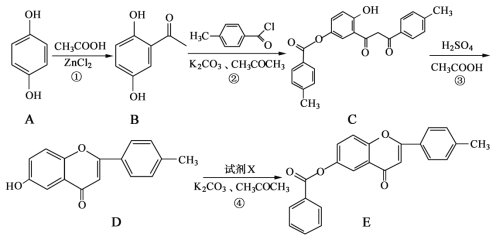
请回答下列问题:
(1)化合物B中的含氧官能团为__________和_____________(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_____________和_____________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________________。
(4)B的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___________________
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
(5)已知: 。根据已有知识并结合相关信息,写出以
。根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备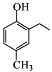 的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:
的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示。下列叙述正确的是
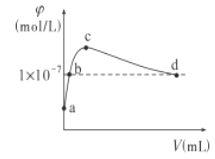
A.a点溶液中:水电离出的c(H+)=1×10-10mol/L
B.b点溶液中:n(Na+)=1×10-10mol
C.c点溶液中:c(Na+)>c(![]() )>c(
)>c(![]() )
)
D.d点溶液中:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com