
【题目】一定条件下,有机化合物Y可发生重排反应:
 (X)
(X)![]()
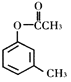 (Y)
(Y)![]()
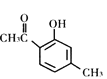 (Z)
(Z)
下列说法不正确的是
A.X、Y、Z互为同分异构体
B.1mol X最多能与3molH2发生加成反应
C.1mol Y最多能与2molNaOH发生反应
D.通过调控温度可以得到不同的目标产物
科目:高中化学 来源: 题型:
【题目】已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是________,判断理由是_________________________________。
(2)写出相应物质的化学式:A___________,C___________。
(3)写出实验②中有关反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a制备,b会发生较多的副反应.回答下列问题:
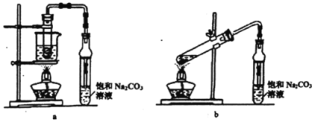
(1)实验时,通常加入过量的乙醇,原因是_____。
(2)饱和Na2CO3溶液的作用是_____。
(3)反应结束后,将盛有饱和Na2CO3溶液的试管中收集到的产品倒入分液漏斗中,_____、_____,然后分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是
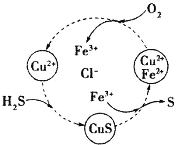
A.在转化过程中化合价不变的元素只有Cu和Cl
B.由图示的转化可得出氧化性的强弱顺序:O2>Cu2+>S
C.在转化过程中能循环利用的物质只有FeCl2
D.反应中当有34gH2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2的质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验的说法不正确的是
A.过滤、萃取、结晶都是依据物质溶解度差异进行的分离提纯
B.可用冷却热饱和溶液的方法除去NaCl中混有的少量KNO3
C.取少量火柴头浸泡液加入硝酸银、稀硝酸和NaNO2,若出现白色沉淀,说明火柴头含氯元素
D.检验海带中碘元素的方法:灼烧→溶解→过滤→氧化→检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中,锗和硅位于同主族。四氯化锗(GeCl4)是光导纤维的掺杂剂,其熔点为-49.5℃, 沸点为83.1℃;易水解,对上呼吸道及皮肤有刺激作用。实验室制备四氯化锗的原理是:Ge+2Cl2=GeCl4。某课题组同学拟选择下列装置设计实验制备四氯化锗(部分加热装置和夹持装置省略)。回答下列问题:
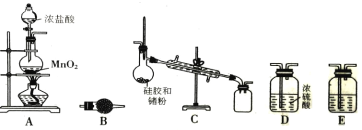
(1)写出A装置中发生反应的化学方程式_______________。
(2)若气体从左到右流动,则装置连接顺序为A、_______________。
(3)C装置中用于冷凝四氯化锗蒸气的仪器名称是_______________,B装置中的试剂是_______________。
(4)E装置中的试剂是_______________,其作用是_______________。
(5)下列有关说法正确的是_______________。
①实验中,先通入氯气,后加热C中烧瓶
②C装置中温度计的温度控制在49℃左右
③观察到D瓶有气泡和液面上有黄绿色气体
④C装置中硅胶的主要作用可能是干燥产品
(6)四氯化锗遇水蒸气产生一种强酸和一种弱酸。实验室用足量NaOH溶液吸收尾气中少量四氯化锗气体,写出该反应的化学方程式:__________________。
(7)实验中消耗m g 纯锗粉制得a g GeCl4,则锗的利用率为_______________(用含 m、a 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com