
【题目】为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放 出气体的体积和时间的关系如图所示.请依图回答下列问题:
(1)放出一半气体所需要的时间为;
(2)A,B,C,D各点反应速率快慢的顺序是
(3)过氧化氢溶液的初始物质的量浓度为 .
【答案】
(1)1 min
(2)D>C>B>A
(3)0.11 mol?L﹣1
【解析】解:(1)由图像可知,当放出一半气体所需要的时间为1min,所以答案是:1 min; (2)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,所以答案是:D>C>B>A; (3)由反应方程式为:2H2O2 ![]() 2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图像可知,生成氧气的体积为60mL,
2H2O2 |
| 2H2O+ | O2↑ |
2mol | 22.4L | ||
n(H2O2) | 0.06L |
n(H2O2)= ![]() =0.00536mol,所以c(H2O2)=
=0.00536mol,所以c(H2O2)= ![]() =0.11 molL﹣1 ,
=0.11 molL﹣1 ,
所以答案是:0.11 molL﹣1 .


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示. 
(1)A点的沉淀物的化学式为 .
(2)写出A点至B点发生反应的离子方程式: .
(3)原混合物中NaOH的质量是g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示.下列有关说法,错误的是( ) 
A.若C为酸性气体,则B可能具有两性
B.若C是碱性气体,则B一定是碱
C.若B,C是两种酸,则B,C一定都是一元酸
D.以上3个转变可能都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途.
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4H2O晶体.
①沉淀溶解的离子方程式为;
②Cu(NH3)4SO4H2O晶体中存在的化学键有;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42﹣的立体构型是 , 其中S原子的杂化轨道类型是;
(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为 , 若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是(只用数字列算式) 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X,Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( ) 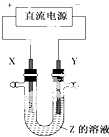
A.氯碱工业中,X,Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是 .
A.SO32﹣和NO2﹣
B.NO3﹣和SO3
C.H3O+和ClO3﹣
D.PO43﹣和SO32﹣
(2)CaF2的晶胞如图所示. 
①下列有关CaF2的表达正确的是
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示,已知[AlF6]3﹣在溶液中可稳定存在).
③晶胞中F﹣的配位数是 , 与一个Ca2+等距离且最近的Ca2+有个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJmol﹣1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
④写出Cu原子核外电子排布式;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为 . 利用反应6NO2+8NH37N2+12H2O也可处理NO2 . 当消耗的NO2在标准状况下为67.2L转移电子数为 .
(2)已知:NO2(g)+SO2(g)SO3(g)+NO(g)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 . a.体系压强保持不变 b混合气体颜色保持不变
c.体系内密度保持不变 d.每消耗1mol SO3的同时消耗1mol NO2
e.体系内的平均摩尔质量保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚂蚁分泌的蚁酸主要成分是甲酸(结构式为 ![]() ,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10﹣4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
(1)该组同学选择如图1所示的装置探究HCOOH在浓硫酸作用下分解产生了CO,请完成下列各小题. 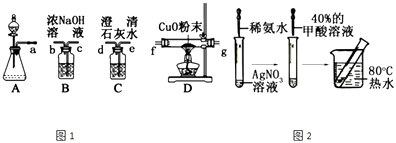
(i)写出甲酸分解的化学方程式;
(ii)装置的连接顺序a;
(iii)HCOOH的分解产物中有CO的现象;
(iv)该实验设计有一处明显的缺陷是;
(2)该组同学分析了甲酸分子结构后,认为甲酸能发生银镜反应,并设计了如图2所示的实验.
(i)依图所示的实验,加热20分钟后并没有出现光亮的银镜.请解释实验中没有产生银镜的原因;
(ii)请设计实验来验证你的解释 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com