
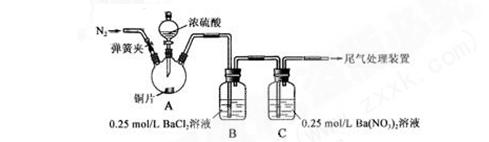
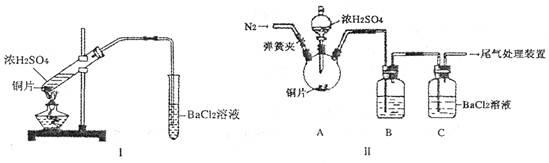
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | ___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 尚 未发现白色沉淀溶解 未发现白色沉淀溶解 |
 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:实验题
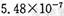 ,饱和亚硫酸中
,饱和亚硫酸中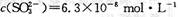 。
。
| A.NaOH溶液 | B.Na[Al(OH)4]溶液 | C.H2O2溶液 | D.酸性 KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
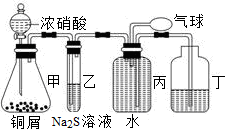
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
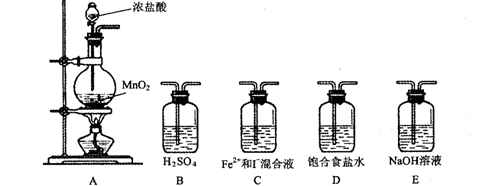
 (按氯气流向的顺序用序号书写)
(按氯气流向的顺序用序号书写) ⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。
⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化, (能或不能)判断反应的先后顺序。| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 ; 向B试管中滴加 : | ① 若 则假设1成立 ② 若 则假设2成立 ③ 若 则假设3成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
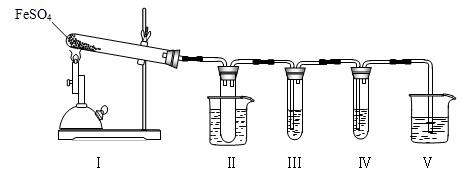
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入__________ ___。 | 产生大量白色沉淀,证明气体产物中含有SO3。 |
| 装置Ⅳ的试管中加入_______ _________。 | ______________________________ ______________________________ ______________________________ ______________________________ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
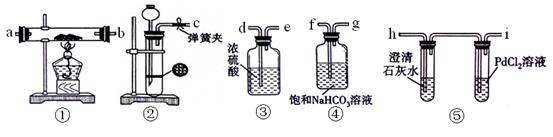
| A.NaNO3溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
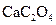 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作: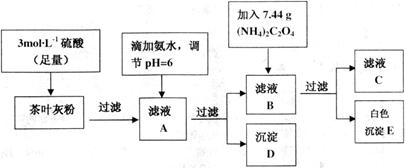
| 离子 | 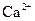 | 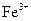 |
| 完全沉淀时的pH | 13 | 4.1 |
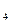 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为: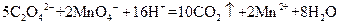 。
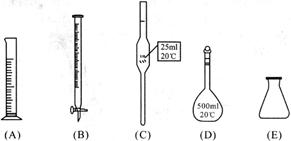
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.观察 | B.实 验 验 | C.分类 | D.比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com