
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:分析 (1)摩尔质量在数值上等于相对分子质量;根据化学式中原子数目计算;
(2)由图中标签知葡萄糖的质量为25g,根据n=$\frac{m}{M}$计算葡萄糖的物质的量,再根据c=$\frac{n}{V}$来计算该注射液中葡萄糖的物质的量浓度;
(3)由注射液的标签可知,500mL溶液中含有葡萄糖25g,据此计算配制100mL该浓度溶液需要葡萄糖质量;
配制100mL该浓度葡萄糖溶液需要玻璃仪器有:量筒、烧杯、胶头滴管、玻璃棒、100mL容量瓶等;
(4)①容量瓶在使用前要检验是否漏水;
②定容时仰视刻度线,所配溶液体积偏大;
③定容时加水超过刻度线,所配溶液浓度偏小,需重新配制;
④摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀.
解答 解:(1)摩尔质量在数值上等于相对分子质量,葡萄糖(化学式为C6H12O6),其相对分子质量为180,则葡萄糖摩尔质量为180g•mol-1;葡萄糖(化学式为C6H12O6),分子中中碳、氢、氧三种元素的质量比为(12×6):(1×12):(16×6)=6:1:8;
故答案为:180g•mol-1;6:1:8;
(2)葡萄糖的质量为25g,其物质的量n=$\frac{25g}{180g/mol}$≈0.1389 mol,则c=$\frac{0.1389mol}{0.5L}$≈0.28mol/L,
故答案为:0.28mol/L;
(3)由注射液的标签可知,500mL溶液中含有葡萄糖25g,故配制100mL该浓度溶液需要葡萄糖质量为25g×$\frac{100mL}{500mL}$=5g,配制100mL该浓度葡萄糖溶液需要玻璃仪器有:量筒、烧杯、胶头滴管、玻璃棒、100mL容量瓶等;
故答案为:5;玻璃棒、250mL容量瓶;
(4)①配制最后需反复颠倒摇匀,故使用容量瓶前检查它是否漏水,故①正确;
②定容时仰视刻度线,所配溶液体积偏大,导致所配溶液浓度偏小,故②错误;
③定容时加水超过刻度线,所配溶液浓度偏小,将溶液倒掉,洗涤容量瓶,需重新配制,故③错误;
④摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故④正确;
故答案为:②③.
点评 本题考查质量分数及物质的量浓度有关计算、溶液配制等,难度不大,注意根据c=$\frac{n}{V}$理解一定物质的量浓度配制,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题

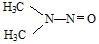 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=$\frac{y}{2}$ | B. | x=0.1+$\frac{y}{2}$ | C. | y=2(x+0.1) | D. | y=2x+0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
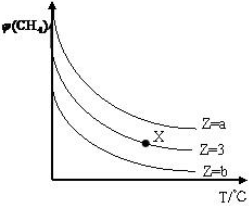 一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)设起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示,下列说法错误的是( )| A. | 该反应的焓变△H>0 | |
| B. | 图中Z的大小为b>3>a | |
| C. | 图中X点对应的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 温度不变时,图中X点对应的平衡在加压后φ(CH4)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
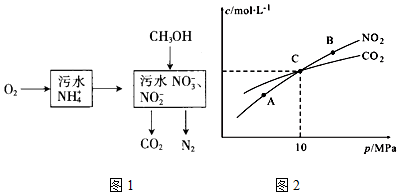
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
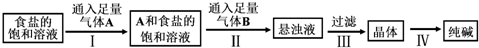
| A. | 气体A是NH3,气体B是CO2 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 第III步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com