
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)根据化学反应方程式和化学平衡常数的概念书写K的表达式,注意C为固体;
(2)温度升高,化学平衡常数增大,说明平衡正向移动;
(3)达到化学平衡状态,各组分浓度不变,正逆反应相等;
(4)平衡浓度符合c(CO)•c(H2)=c(H2O),可知K=1;
(5)为了提高H2O(g)的转化率,可使平衡正向移动,结合温度、压强对平衡移动的影响判断.
解答 解:(1)C为固体,则K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,故答案为:$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)由于温度升高,该反应的化学平衡常数减小,平衡向着逆向移动,正向反应是放热反应,则逆反应为吸热反应,故答案为:吸热;
(3)A.反应前后气体的体积不等,则容器内压强不变,可说明达到平衡状态,故A不选;
B.混合气体中c(CO)不变,说明达到平衡状态,故B不选;
C.v正(H2)=v逆(H2O),说明正逆反应速率相等,说明达到平衡状态,故C不选;
D.无论是否达到平衡状态,都满足c(H2)=c(CO),故D选.
故答案为:D;
(4)平衡浓度符合c(CO)•c(H2)=c(H2O),可知K=1,则温度为830℃,故答案为:830;
(5)为了提高H2O(g)的转化率,可使平衡正向移动,可减小压强,应正反应为放热反应,则还可降低温度,故答案为:减小压强,降低温度.
点评 本题主要考查温度对化学平衡、化学平衡常数的影响,为高频考点,难度不大,题目侧重考查学生分析和解决问题的能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
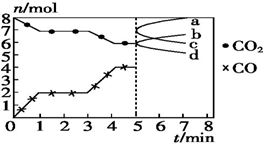 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )| A. | 0~1 min,v(CO)=1 mol•L-1•min-1;1~3 min,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,反应一定达到平衡状态,$\frac{P(平衡)}{P(起始)}$<1 | |
| C. | 3 min时,温度由T1升高到T2,则Q>0,再达平衡时,$\frac{K({T}_{2})}{K({T}_{1})}$>1 | |
| D. | 5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com