
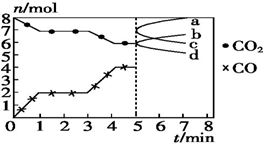
 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )| A. | 0~1 min,v(CO)=1 mol•L-1•min-1;1~3 min,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,反应一定达到平衡状态,$\frac{P(平衡)}{P(起始)}$<1 | |
| C. | 3 min时,温度由T1升高到T2,则Q>0,再达平衡时,$\frac{K({T}_{2})}{K({T}_{1})}$>1 | |
| D. | 5 min时再充入一定量的CO,a、b曲线分别表示n(CO)、n(CO2)的变化 |
分析 A、依据图象分析单位时间内一氧化碳和二氧化碳物质的量浓度的变化,结合化学反应速率概念分析计算,1-3min反应达到平衡判断;
B、反应是气体体积增大的反应,压强不变,说明反应达到平衡,反应气体物质的量之比等于压强之比;
C、依据图象3min升高温度,一氧化碳增多,说明反应是吸热反应,分析图象平衡物质的量,计算平衡状态下平衡常数;
D、改变一氧化碳的量,增加一氧化碳,瞬间一氧化碳物质的量增大,然后反应平衡逆向进行,一氧化碳减小,二氧化碳增大.
解答 解:A、依据图象分析单位时间段内一氧化碳和二氧化碳物质的量的变化,0~1min,一氧化碳物质的量增加2mol,反应速率υ(CO)=$\frac{\frac{2mol}{2L}}{1min}$=1 mol/(L•min);1~3min时,平衡不动,反应速率等于化学计量数之比,υ(CO)=2υ(CO2),故A错误;
B、反应是气体体积增大的反应,压强不变,说明反应达到平衡,反应气体物质的量之比等于压强之比,P(平衡)>P(起始),$\frac{P(平衡)}{P(起始)}$>1,故B错误;
C、依据图象3min升高温度,一氧化碳增多,说明反应是吸热反应,T1温度平衡,一氧化碳物质的量为2mol,二氧化碳物质的量为7mol;平衡常数K1=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$=$\frac{(\frac{2mol}{2L})^{2}}{\frac{7mol}{2L}}$=$\frac{2}{7}$;T2温度平衡,一氧化碳物质的量为4mol,二氧化碳物质的量为6mol,平衡常数K2=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$=$\frac{(\frac{4mol}{2L})^{2}}{\frac{6mol}{2L}}$=$\frac{4}{3}$,则$\frac{{K}_{{T}_{1}}}{{K}_{{T}_{2}}}$=4,7>1,故C正确;
D、改变一氧化碳的量,增加一氧化碳,瞬间一氧化碳物质的量增大,然后反应平衡逆向进行,一氧化碳减小,二氧化碳增大,a为二氧化碳,c为一氧化碳;故D错误;
故选C.
点评 本题考查图象分析判断,反应速率计算应用,平衡常数计算判断,平衡影响因素的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol/(L•s) | B. | 0.012 5 mol/(L•s) | C. | 0.05 mol/(L•s) | D. | 0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
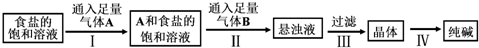
| A. | 气体A是NH3,气体B是CO2 | |
| B. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| C. | 第III步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 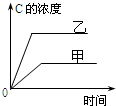 研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 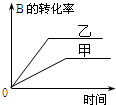 研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 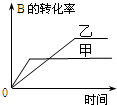 研究的是温度对反应的影响,且乙的温度较高 | |
| D. | 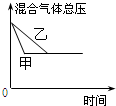 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在 2L 容积不变的密闭容器内,800℃时反应 2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应是可逆反应 | |
| B. | 放电时,镉为正极 | |
| C. | 充电时电池上标有“+”号的电极连接电源正极 | |
| D. | 以镍镉电池为电源,电解Na2CO3溶液,当收集到气体的总体积为33.6L电池中转移了2mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com