
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
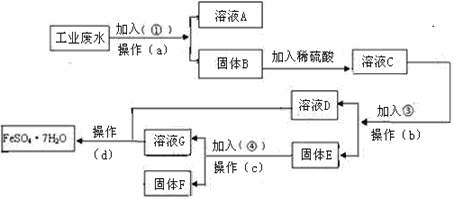
(1)加入的试剂①为______(填化学式),加入试剂①的目的是______。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为______。洗涤固体B的操作是________。
(3)固体E的成分为_____,加入的试剂④为_____,发生的化学方程式为_________。
(4)从溶液D和溶液G中得到FeSO47H2O晶体的操作为______、______、______、洗涤、干燥。
【答案】NaOH 将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离 漏斗、玻璃棒、烧杯 沿玻璃棒向过滤器中加蒸馏水至刚好没过沉淀B,静置,使水自然流出,重复2~3次 Fe和Cu 稀硫酸 Fe+H2SO4=FeSO4+H2↑ 蒸发浓缩 冷却结晶 过滤
【解析】
(1)工业废水中含有Na+、Fe2+和Cu2+,加入NaOH溶液,使将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离;综上所述,本题答案是:NaOH ,将溶液中的Fe2+和Cu2+转化为沉淀,便于与含有Na+的溶液分离。
(2)操作a的名称为过滤,所需要的玻璃仪器为:漏斗、玻璃棒、烧杯;洗涤固体B的操作:沿玻璃棒向过滤器中加蒸馏水至刚好没过沉淀B,静置,使水自然流出,重复2~3次;综上所述,本题答案是:漏斗、玻璃棒、烧杯 ;沿玻璃棒向过滤器中加蒸馏水至刚好没过沉淀B,静置,使水自然流出,重复2~3次。
(3)溶液C的成分为CuSO4,FeSO4、H2SO4,过量的铁是为了将CuSO4中的铜全部置换出来,过滤出Fe、Cu,溶液D中只有一种盐是硫酸亚铁,所以固体E就是Fe、Cu;铜与稀硫酸不反应,铁与硫酸反应,方程式为Fe+H2SO4=FeSO4+H2↑;所以混合物中加入过量稀硫酸的目的是除去铜中的铁,实现了回收金属铜;因此,本题正确答案是: Fe和Cu;稀硫酸 Fe+H2SO4=FeSO4+H2↑。
(4)蒸发是从溶液中获得晶体常采用的方法,产生沉淀后通过过滤实现分离,因此从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、冷却结晶、过滤;因此,本题正确答案是: 蒸发浓缩、冷却结晶、过滤。


科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又是吸热反应的是( )
A.锌粒与稀硝酸的反应
B.灼热的木炭与CO2的反应
C.过氧化钠与水的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将饱和FeCl3溶液滴入沸水时,液体变为红褐色,得到的是Fe(OH)3胶体。用此分散系进行实验:
(1)请写出制备Fe(OH)3胶体的化学方程式____________________________________________。
(2)证明有 Fe(OH)3 胶体生成的实验操作是用一束光照射此液体,可以看到有光亮的通路,利用的胶体性质是______________。
(3)将Fe(OH)3 胶体装入U形管内,用石墨做电极,接通直流电源,通电一段时间后发现阴极附近颜色加深,这种现象叫_____。
(4)向Fe(OH)3 胶体中逐滴加入稀硫酸,可以看到有红褐色沉淀产生,因为胶体发生了_______,继续滴加稀硫酸直至过量,可以看到的实验现象是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s)+H2O(g)=CO(g)+H2(g) △H1=akJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=ckJ/mol
④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=dkJ/mol
A. 反应①、②为反应③提供原料气,且a>0
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)=1/2CH3OCH3(g)+1/2H2O(g) △H=d/2kJ/mol
D. 反应2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的△H=-(2b+2c+d)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。

(1)步骤1所需玻璃仪器是_________;步骤3的操作名称是____________。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有____________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是___________。
②填写下表:______
实验步骤 | 预期现象和结论 |
步骤4: | ①若,则假设成立 ②若,则成立 |
步骤5: |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比是( )
A.1:1
B.2:1
C.1:3
D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.无色溶液中:Na+、Cu2+、NO3﹣、Cl﹣
B.在pH=4的溶液中:Na+、K+、OH﹣、Cl﹣
C.在含Ba2+的溶液中:H+、Na+、Cl﹣、SO42﹣
D.与Fe反应产生气体的溶液:Na+、K+、Cl﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L(标准状况)。该反应方程式为:Cl2+2NaOH=NaCl+ NaClO+H2O
(1)则选用所贴标签为2.0mol·L—1的氢氧化钠,至少需该氢氧化钠溶液_____毫升。
(2)如选用所贴标签为10%(密度为1.043gmL—1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸________毫升(保留小数点后一位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com