
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 170℃ |
| 水浴 |
| △ |
| 水浴 |
| △ |


科目:高中化学 来源: 题型:
 能用下列装置净化、并能进行验证的气体是( )
能用下列装置净化、并能进行验证的气体是( )| 选项 | 制取气体 | 试剂x | 试剂y |
| A | 实验室用浓H2SO4与乙醇反应制取乙烯气体 | NaOH溶液 | 品红溶液 |
| B | 用电石与饱和食盐水反应制乙炔气体 | 饱和NaCl溶液 | 稀Br2水溶液 |
| C | 用浓NH3?H2O与生石灰反应制取氨气 | 浓H2SO4 | 稀酚酞溶液 |
| D | 用CaCO3固体与HCl反应制取CO2气体 | 饱和NaHCO3溶液 | 澄清石灰水溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
容器 |
甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
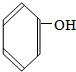 ②
②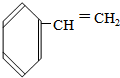 ③
③ ④
④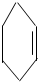 ⑤
⑤ ⑥
⑥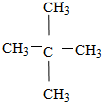
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I A族元素的金属性比ⅡA族元素的金属性强 |
| B、ⅥA族元素的氢化物中,最稳定的氢化物常温时为无色液体 |
| C、某主族元素X的气态氢化物化学式为HX,则一定有最高正价+7价 |
| D、金属元素的原子只有还原性,金属阳离子只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用含硅胶、铁粉的透气小袋与食品一起密封包装 |
| B、用热碱水清除炊具上残留的油污 |
| C、用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D、用活性炭去除冰箱中的异味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com