
科目:高中化学 来源: 题型:阅读理解
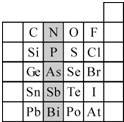 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.

查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源: 题型:
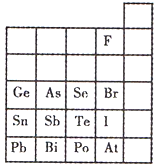 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.查看答案和解析>>
科目:高中化学 来源:高一化学 专题1 微观结构与物质的多样性 1.1.2元素周期律(苏教版必修2) 题型:013
|
F与Cl的原子半径,前者和后者的关系是 | |
| [ ] | |
A. |
大于 |
B. |
小于 |
C. |
等于 |
D. |
不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com