
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式:
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式:
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
请写出该电池在充电时阴极的电极反应式:
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl一、SO42一
B.与铝反应产生大量氢气的溶液:Na+、K+、HCO3—、NO3一
C. pH=12的溶液: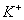 、
、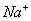 、
、 、Br-
、Br-
D. 由水电离产生的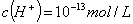 的溶液:
的溶液: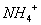 、
、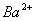 、
、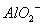 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)==CO2(g) △H1 C(s)+1/2O2(g)==CO(g) △H2
②S(s)+O2(g)==SO2(g) △H3 S(g)+O2(g)==SO2(g) △H4
③H2(g)+1/2O2(g)==H2O(l) △H5 2H2(g)+O2(g)==2H2O(l) △H6
④CaCO3(s)==CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)==Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科技、社会、生产密切结合,下列有关说法正确的是
A.“纯净水”清洁、纯净,长期饮用有益健康
B.维生素C不宜与含硫酸亚铁的补血剂同服
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.味觉上具有酸味的食物即酸性食物,长期食用会导致血液偏酸性,引起缺钙
查看答案和解析>>
科目:高中化学 来源: 题型:
研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V ≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
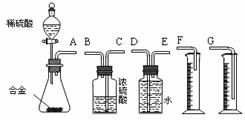 【方案二】将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况
【方案二】将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况
(约20℃,1.01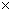 105Pa)的体积。
105Pa)的体积。
〖问题讨论〗
(1)同学们拟选用下列实验装置完成实验:
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,发现稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
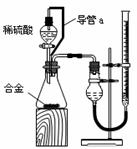 D.视线与凹液面最低点水平,读取量筒中水的体积
D.视线与凹液面最低点水平,读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用有:使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下和
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_____ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol金属Al全部转化为Al(OH)3,消耗HCl a mol,NaOH b mol,则a+b的最小值为( )
A.4 B.6
C.8 D.16
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com