
将4 mol金属Al全部转化为Al(OH)3,消耗HCl a mol,NaOH b mol,则a+b的最小值为( )
A.4 B.6
C.8 D.16
科目:高中化学 来源: 题型:
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式:
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式:
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
请写出该电池在充电时阴极的电极反应式:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应的快慢和限度对人类生产生活有重要的意义
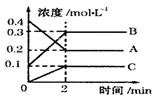
|
(1)该反应的方程式为 。
(2)2min内,C的反应速率为 。
(3)下列可作为判断反应已达到该状态的是________(填序号)。
A.A、B、C浓度相等 B.A、B的反应速率比为2∶3
C.A、B、C浓度保持不变,且不为0 D.生成A、C的速率相等
(4)对于上述反应在不同条件下的化学反应速率表示中,反应速率最快的是:( )
A、v(B) =0.8mol/(L•s) B.v(A) =0.4mol/(L•s)
C.v(C) =0.6mol/(L•s) D.v(B) =4.2mol/(L•min)
查看答案和解析>>
科目:高中化学 来源: 题型:
将表面积和体积均相等的大理石,分别投入过量的甲溶液(0.1 mol/L HCL)与乙溶液(0.1 mol/L醋酸)中,则( )
A初始的速率甲、乙相同,生成二氧化碳的总量甲、乙也相同
B初始的速率甲大于乙,生成二氧化碳的总量也是甲大于乙
C初始的速率甲大于乙,生成二氧化碳的总量甲、乙相同
D反应速率和生成二氧化碳的总量均不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
以铝屑为原料制备Al(OH)3实验方案的设计
(1)设计方案一:用稀硫酸跟铝屑反应,使铝转化为Al3+的溶液,再用NaOH溶液使Al(OH)3沉淀析出。
化学方程式:_________________________________。
(2)设计方案二:将铝屑跟浓NaOH溶液反应,再用稀硫酸中和过量的碱液,并促使AlO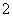 水解,以得到Al(OH)3。
水解,以得到Al(OH)3。
化学方程式:_________________________________。
(3)设计方案三:用铝屑分别与稀硫酸和浓NaOH溶液反应,然后将得到的铝盐溶液混合过滤,再将得到的沉淀洗涤,即可得到Al(OH)3。
化学方程式:_________________________________。
(4)计算方案一、方案二和方案三中酸、碱的用量填写下表:
| 方案 | 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| 方案一 | ||
| 方案二 | ||
| 方案三 |
(5)对于上述三种设计方案,从反应物种类看,三种方案都使用了三种药品。从消耗酸、碱的物质的量来分析,方案________用量最多,方案________用量最少;从操作要求考虑,方案________也最为简单。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子aW3+、bX+、cY2—、dZ— 都具有相同的电子层结构,下列关系正确的是( )
A.原子序数c>b B.离子的氧化性W3+>X+
C.a+3=c-2 D.原子半径X<Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com