
【题目】0.1mol某元素的单质直接与足量氯气反应,质量增加7.1g,这种元素可能是( )
A. NaB. CuC. FeD. Al
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将4 mol A和8 mol B加入体积为2 L的某密闭容器中,反应至4 min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是
2C(g)+D(g)。现将4 mol A和8 mol B加入体积为2 L的某密闭容器中,反应至4 min时,改变某一条件,测得C的物质的量浓度随时间变化的曲线如图所示。下列有关说法中正确的是

A. 0~2 min内,正反应速率逐渐增大
B. 4 min时,A的转化率为50%
C. 6 min时,B的体积分数为25%
D. 4 min时,改变条件后,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
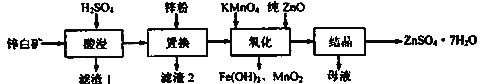
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生氧化还原反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是_______________________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
(5)ZnSO4 ·7H2O可用于配制铁件上镀锌电镀池的电解液,下列说法不正确的是_______
A.配制一定物质的量浓度ZnSO4溶液时必需的玻璃仪器为容量瓶、烧杯、玻璃棒
B.电镀池的阳极为铁件
C.阴极质量增加65g时,理论上导线中通过2mol电子
D.电镀过程中电解质溶液的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种在工业生产中有广泛用途的有机高分子结构片段如图。下列关于该高分子的说法正确的是

A. 能水解成小分子
B. 单体只含有一种官能团
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B. 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C. 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和化学平衡影响的图象,其中图象和实验结论表达错误的是




A. a是其他条件一定时,反应速率随温度变化的图象,正反应ΔH > 0
B. b是在有无催化剂存在下建立的平衡过程图象,Ⅰ是使用催化剂时的曲线
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察下图(左),标准液盐酸应放入___________滴定管中。(填“甲”或“乙”)


(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________________________,滴定终点的现象为_______________。
(3)若滴定开始和结束时,酸式滴定管中的液面如上图(右)所示,则起始读数为___________mL,所用盐酸溶液的体积为___________________mL。
(4)某学生根据3次实验分别记录有关数据如表所示:

依据表中数据计算该NaOH溶液的物质的量浓度________________。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com