
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
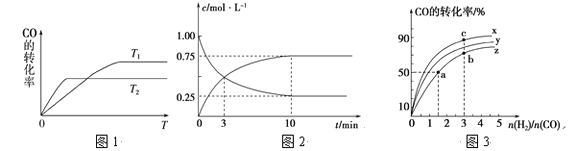
(1)如图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH________0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________。
【答案】< > 12 b 270 K1=K2< K3
【解析】
(1)①根据图像信息结合勒夏特列原理判断;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小;利用三段式计算平衡时各量的浓度,再计算K。
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
(2)反应为放热反应,温度越高CO的转化率越小;化学平衡常数只与温度有关,反应为放热反应,升高温度,平衡常数减小。
(1)①根据图中的信息可知:T2>T1,温度越高CO转化率越小,则反应CO(g)+2H2(g)![]() CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小,T2>T1,则K1>K2;在T1温度下,根据图2所示,10min时达到平衡状态,已知CO的浓度为1mol/L,则图像为CO与CH3OH的浓度变化,平衡时,c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始:1 2 0
反应:0.75 1.5 0.75
平衡:0.25 0.5 0.75
K=0.75/(0.25×0.52)=12;
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
答案为b;
(2)反应为放热反应,温度越高CO的转化率越小,曲线Z为270℃;化学平衡常数只与温度有关,则K1=K2,反应为放热反应,升高温度,平衡常数减小,则曲线x为230 ℃,K1=K2< K3。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】有关元素W、X、Y、Z的信息如下,请用化学用语完成下列问题:
元素 | 信息 |
W | 所在主族序数与所在周期序数之差为4,其单质在常温下呈黄绿色 |
X | X+的电子层结构与Ne相同 |
Y | 生活中常见的金属,其制品在潮湿的空气中会生锈 |
Z | 地壳中含量最多的金属元素 |
(1)请写出Z元素在周期表中的位置________。请写出Z高价氧化物的水化物与X最高价氧化物水化物反应的离子方程式________。
(2)X在空气中加热,生成一种淡黄色固体,该固体的电子式是________。
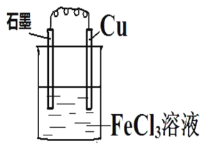
(3)以铜棒、石墨为电极材料,YW3溶液为电解质溶液,形成如图所示的原电池,则该原电池正极的电极反应式为________。如何检验正极反应的产物离子,请简述操作过程及现象________,________。
(4)Y和Z单质混合物质量为3.28g,总物质的量为0.1mol。加入足量盐酸溶解,再加入适量H2O2溶液,然后加入氨水恰好完全沉淀,过滤、洗涤、干燥,得到固体的质量为________g。加入H2O2溶液反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前36号元素。其中A与B在周期表中位置相邻,A原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;B的基态原子有7种不同运动状态的电子;C原子在同周期原子中原子半径最大(稀有气体除外);D原子的L电子层中有两个未成对电子,且无空轨道;E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、D四种元素第一电离能从小到大顺序为_____。
(2)A的稳定氧化物中,中心原子的杂化类型为____,空间构型为_____。
(3)C与电负性最大的元素形成的化合物与B的氢化物熔沸点______更高,原因是_______。
(4)E的某种化合物的结构如图所示。
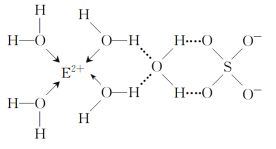
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有____。
A: 离子键 B: 共价键 C: 配位键 D: 氢键
(5)元素金(Au)处于周期表中的第六周期,与E同族。一种E合金晶体具有立方最密堆积的结构,在晶胞中E原子处于面心,金原子处于顶点位置,则该合金中E原子与金原子数量之比为____;该晶体中,原子之间的作用力是_____。
(6)上述晶体具有储氢功能,氢原子可进入到由铜原子与金原子构成的四面体空隙中。若将铜原子与金原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备沉淀Fe(OH)2
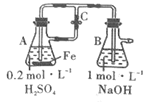
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
D.FeCl3溶液中滴加KSCN溶液会生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
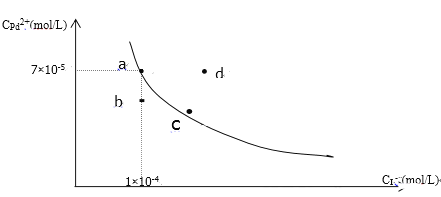
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间的化学反应,反应产物一定为纯净物的是
A.CH3CH3+Cl2![]()
B.CH3-CH=CH-CH3+Br2
C.CH2=CH-CH2-CH3+HCl![]()
D.CH3-CH=CH2+H2O![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
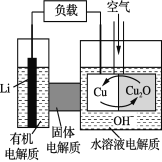
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家运用穿山甲的鳞片特征,制作出具有自我恢复性的防弹衣,具有如此神奇功能的是聚对苯二甲酰对苯二胺(G)。其合成路线如下:
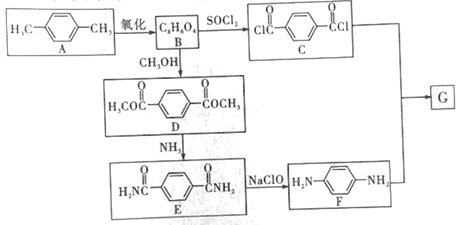
回答下列问题:
(1)A的化学名称为___。
(2)B中含有的官能团名称为___,B→C的反应类型为___。
(3)B→D的化学反应方程式为___。
(4)G的结构简式为___。
(5)芳香化合物H是B的同分异构体,符合下列条件的H的结构共有___种(不考虑立体异构),其中核磁共振氢谱有四组峰的结构简式为___。
①能与NaHCO3溶液反应产生CO2;②能发生银镜反应
(6)参照上述合成路线,设计以![]() 为原料(其他试剂任选),制备
为原料(其他试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分生成物与反应条件已略去)。B、D、H 是气体,B 是单质,D 能使湿润的红色石蕊试纸变蓝;C、G 是生活中的常见金属,工业上用反应①制备 C;K、F 是固体,其中F 是一种红色涂料的主要成分。
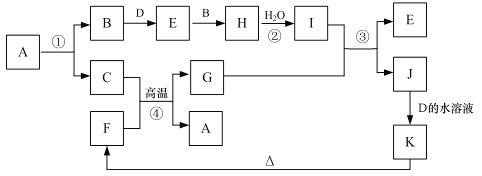
(1)K的化学式为___________;D 的电子式为____________。
(2)写出反应②的离子方程式: ___________。
(3)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目:_____________。
(4)物质J 常用作催化剂,媒染剂,放射性物质吸附剂。从J的溶液得到J的晶体的操作依次为_____________、冰水洗涤、减压烘干。冰水洗涤的目的___________。
(5)反应③常通过微热来加快反应的速率,加热时温度不能过高的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com