
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
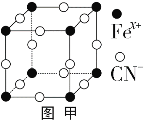
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
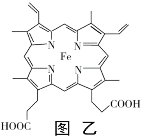
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________

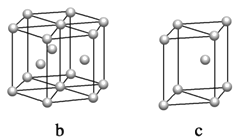
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
【答案】[Ar]3d5(或1s22s22p63s23p63d5) CO2或CS2 1∶1  六方最密堆积 c 12 NAaρ g/mol
六方最密堆积 c 12 NAaρ g/mol
【解析】
(1)铁元素是26号元素,其核外电子排布式为[Ar]3d64s2,失电子先失去最外层电子,然后书写Fe3+基态电子排布式;
(2)根据等电子体的定义进行分析;
(3)平均每两个晶胞立方体中含有1个K+,说明每个晶胞中含有![]() 个K+,然后用均摊方法得到Fex+和CN-的个数,求出化学式,最后判断出Fe2+和Fe3+的个数比;
个K+,然后用均摊方法得到Fex+和CN-的个数,求出化学式,最后判断出Fe2+和Fe3+的个数比;
(4)N最外层有5个电子,形成三个共价键达到饱和,多余的键为配位键,进行分析;
(5)根据图a,镁单质堆积方式为六方最密堆积,配位数为12,然后根据密度定义进行分析;
(1)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为[Ar]3d64s2,则Fe3+的基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5);
(2)SCN中含有3个原子,且其价电子数是16,与SCN互为等电子体的一种非极性分子的为CO2(或CS2);
(3)平均每两个晶胞立方体中含有一个K+,所以一个晶胞中钾离子个数=![]() =0.5,该立方体中铁原子个数=8×
=0.5,该立方体中铁原子个数=8×![]() =1,CN位于每条棱中点,该立方体中含有CN个数=12×
=1,CN位于每条棱中点,该立方体中含有CN个数=12×![]() =3,平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,即亚铁离子与铁离子之比是1:1;
=3,平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,即亚铁离子与铁离子之比是1:1;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+提供空轨道,N原子提供电子对,Fe2+与N原子间的的配位键为: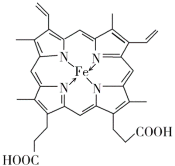 ;
;
(5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,单质晶体中原子为六方最密堆积,配位数为12,晶胞是图中的c;晶胞质量=2![]() g,则ρg·cm3=
g,则ρg·cm3=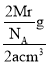 ,则有Mr=NAaρ g/mol。
,则有Mr=NAaρ g/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】绿色化学是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列 化学反应不符合绿色化学概念的是( )
A. 消除硫酸厂尾气排放:SO2+2NH3+H2O=(NH4)2SO3
B. 消除制硝酸厂的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O
C. 制 CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制 CuSO4:2Cu+O2![]() 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
2CuO,CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为纪念门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年为“国际化学元素周期表年”(IYPT2019)。元素周期表隐含着许多的信息和规律,以下所涉及的元素均为中学化学常见短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法不正确的是

A.元素周期表有7个周期,16个族,共有118种元素,其大多数是金属元素
B.x和e组成的化合物属于离子化合物,该化合物具有较强的还原性
C.d、f、g、h的离子半径顺序g>h>d>f
D.y、z、h的最简氢化物的沸点h>z>y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以水钴矿(主要成分为Co2O3,还含Fe、A1、Mg、Ca、Si等元素)制备钴的氧化物,工艺如图所示。回答下列问题:

相关金属离子[co(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:

(1)水钴矿中的Fe、A1、Mg、Ca元素的存在形态为___(填“游离态”或“化合态”)。
(2)“酸溶”中Co2O3反应的离子方程式是___,滤渣1的成分可能是___。
(3)“氧化”中加Co2O3的作用是___。
(4)“调pH”为4.7-6之间,则滤渣2为___。
(5)已知Ksp(CaF2)=5.3×10-9,Ksp(MgF2)=5.2×10-12,“除杂”是为了除去Ca2+和Mg2+,此时先析出的沉淀是___(填化学式),过程中![]() 最大值为___(列出算式即可)。
最大值为___(列出算式即可)。
(6)实验室拟在空气中煅烧CoC2O4以探究其产物。实验时将13.23gCoC2O4放入___(填仪器名称)中,测得生成钴的某种氧化物7.23g和气体CO2。据此预测:该氧化物中Co化合价的可能情况是___,真实情况有待进一步查证。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级TiO2具有独特的光催化性与紫外线屏蔽等功能、具有广阔的工业应用前景。实验室用钛铁精矿(FeTiO3)提炼TiO2的流程如下。下列说法错误的是( )

A.酸浸的化学方程式是:FeTiO3+2H2SO4=FeSO4+TiOSO4+2H2O
B.X稀释所得分散系含纳米级H2TiO3,可用于观察丁达尔效应
C.②用水蒸气是为了促进水解,所得稀硫酸可循环使用
D.①③反应中至少有一个是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化工原料的结构简式如图所示,下列关于该有机物的说法正确的是( )
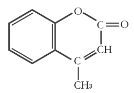
A.1 mol该物质最多能和5mol H2发生加成反应
B.能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C.该分子中所有原子都可能共平面
D.该物质的分子式为C10H10O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有MgCO3固体的浊液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A.c(Mg2+)B.Ksp(MgCO3)C.c(H+)D.c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com