
【题目】A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29。回答下列问题:
(1)五种元素中第一电离能最大的是_____,其中D原子价电子排布图为______。
(2)元素B的简单气态氢化物的沸点______元素A的简单气态氢化物的沸点(填大于或小于),其主要原因是____; A的简单气态氢化物中心原子的杂化轨道类型为________。
(3)BC3-的立体构型为__________,与其互为等电子体的分子是__________(写化学式)。
(4)EC在加热条件下容易转化为E2C,从原子结构的角度解释原因____________;E原子的外围电子排布式为_____________。
(5)硼与D可形成一种耐磨材料F,其结构与金刚石相似(如图)。F的晶胞边长为a cm,则该晶体密度的表达式为___________g·cm-3。(用含a、NA的式子表示, 不必化简)。

【答案】 N 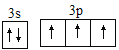 高于 NH3分子之间存在氢键 sp3 平面三角形 SO3 Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定 3d104s1
高于 NH3分子之间存在氢键 sp3 平面三角形 SO3 Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定 3d104s1 ![]()
【解析】A的一种同位素可用于考古中测定生物的死亡年代,A为C元素;C原子的最外层电子数是次外层的3倍,C为O元素;A为第二周期元素,B与A同周期,B的s能级电子数比p能级电子数多,B的原子序数介于A与C之间,B为N元素;E的原子序数为29,E为Cu元素;D与B同主族,D的原子序数介于C与E之间,D为P元素。
(1)五种元素中第一电离能最大的是N。D的价电子排布图为 。
。
(2)沸点NH3![]() CH4,主要原因是NH3分子间存在氢键。CH4中碳原子为sp3杂化。
CH4,主要原因是NH3分子间存在氢键。CH4中碳原子为sp3杂化。
(3)BC3-为NO3-,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
(4)EC为CuO,E2C为Cu2O,CuO在加热条件下容易转化为Cu2O的原因是:Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定。Cu原子的外围电子排布式为3d104s1。
(5)用“均摊法”确定晶胞中含有的原子的个数,由晶胞的边长计算晶胞的体积,进一步计算1mol晶体的体积,1mol晶体的质量除以1mol晶体的体积计算晶体的密度。
A的一种同位素可用于考古中测定生物的死亡年代,A为C元素;C原子的最外层电子数是次外层的3倍,C为O元素;A为第二周期元素,B与A同周期,B的s能级电子数比p能级电子数多,B的原子序数介于A与C之间,B为N元素;E的原子序数为29,E为Cu元素;D与B同主族,D的原子序数介于C与E之间,D为P元素。
(1)根据同周期从左到右第一电离能呈增大趋势,第VA族大于第VIA族,第一电离能N![]() O
O![]() C,同主族从上到下第一电离能逐渐减小,第一电离能N
C,同主族从上到下第一电离能逐渐减小,第一电离能N![]() P,Cu是金属元素,Cu的第一电离能最小,五种元素中第一电离能最大的是N。D为P元素,P原子核外有15个电子,根据构造原理,基态P原子的核外电子排布式为1s22s22p63s23p3,P原子的价电子排布式为3s23p3,D的价电子排布图为
P,Cu是金属元素,Cu的第一电离能最小,五种元素中第一电离能最大的是N。D为P元素,P原子核外有15个电子,根据构造原理,基态P原子的核外电子排布式为1s22s22p63s23p3,P原子的价电子排布式为3s23p3,D的价电子排布图为 。
。
(2)B的简单氢化物为NH3,A的简单氢化物为CH4,沸点NH3![]() CH4,主要原因是NH3分子间存在氢键,CH4分子间不存在氢键。CH4中中心原子C上的孤电子对数为
CH4,主要原因是NH3分子间存在氢键,CH4分子间不存在氢键。CH4中中心原子C上的孤电子对数为![]() (4-4
(4-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,CH4中碳原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,CH4中碳原子为sp3杂化。
(3)BC3-为NO3-,NO3-中中心原子N上的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,N上没有孤电子对,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
2)=0,成键电子对数为3,价层电子对数为0+3=3,VSEPR模型为平面三角形,N上没有孤电子对,NO3-的立体构型为平面三角形。用“替代法”,与其互为等电子体的分子是SO3等。
(4)EC为CuO,E2C为Cu2O,CuO在加热条件下容易转化为Cu2O的原因是:Cu2+外围电子排布为3d9,而Cu+外围电子排布为3d10,为全充满稳定状态,Cu2O 更稳定。Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu原子的外围电子排布式为3d104s1。
(5)B原子最外层有3个电子,P原子最外层有5个电子,B与P形成的化合物的化学式为BP,F的化学式为BP;用“均摊法”金刚石的晶胞中含C原子:8![]() +6
+6![]() +4=8个;F的晶胞中含4个B原子和4个P原子,F的晶胞边长为acm,F的晶胞体积为a3cm3;1mol晶体的体积为
+4=8个;F的晶胞中含4个B原子和4个P原子,F的晶胞边长为acm,F的晶胞体积为a3cm3;1mol晶体的体积为![]() cm3;1mol晶体的质量为42g,该晶体的密度为42g
cm3;1mol晶体的质量为42g,该晶体的密度为42g![]() (
(![]() cm3)=
cm3)=![]() g/cm3。
g/cm3。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列事实描述不正确的是
A. 高溫煅烧石灰石的反应中,反应物总能量高于生成物总能量
B. 中和反应中,反应物总能量高于生成物总能量
C. 铝粉和盐酸反应时,溶液温度通常会上升
D. 氢氧化钡晶体和氯化铵晶体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1L1.0mo1L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
C. Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA
D. 室温下,将9g铝片投入0.5L 18.4molL-1的H2SO4中,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阴离子是OH-、SiO32-、AlO2-、CO32-
B. 反应最后形成的溶液中的溶质为NaCl
C. 原溶液中一定含有Na2SO4
D. 原溶液中CO32-与AlO2-的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
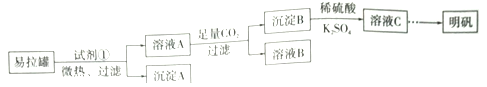
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。

(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,约有80%~85%的化工生产过程使用催化剂,同样在化学实验室进行物质的制取时,也用到催化剂。以下反应不使用催化剂能顺利进行的是
A.实验室用过氧化氢制取氧气B.实验室制取氯气
C.工业上合成氨D.工业上制备硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3 会快速分解为FeBr2。某校同学设计实验用干燥的HBr 与Fe 反应制备少量FeBr2,实验装置如下(部分夹持装置已省略),请回答相关问题:

(1)仪器 M 名称是___,装置④中主要的化学方程式为__________。
(2)装置⑥的作用是___,逸出的气体主要是_____(填化学式)。
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是____。
(4)将浓磷酸换成浓硫酸同样能制得 HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制 HBr 的原因是硫酸和磷酸都具有___(填选项字母)。
a.脱水性 b.强氧化性 c.难挥发性
②溶液变橙黄色是因为发生了副反应____(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度____ (填“有”或“没有”)影响,理由是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2分子的空间结构如右图,H2O2分子不是直线形的,两个氢在犹如在半展开的书的两页上,氧原子则在书的夹缝上,书页夹角为93°,而两个O-H键与O-O键之间的夹角均为96°。有关H2O2结构的说法中不正确的是( )

A. H2O2有3对共用电子对 B. 分子的正、负电荷中心重合
C. H2O2能形成分子间氢键 D. 过氧化氢分子间存在范德华力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com