
【题目】既可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是 ( )
A.通入酸性高锰酸钾溶液中B.通入足量溴水中
C.一定条件下通入H2D.通入水中
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)基态Ti 原子的价层电子排布图为________________________。
(2)在TiO、TiN、TiS2、TiCl4等化合物中,S、Cl的电负性大小:S________Cl (填“>”、“<”或“=”)。O、N 的第一电离能大小为O < N,原因是___________________________。
(3)TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4,该晶体是_______ 晶体。TiCl4中加入大量水,同时加热,可制得二氧化钛的水合物(TiO2·xH2O),再经焙烧可得TiO2,写出生
成二氧化钛水合物(TiO2·xH2O)的化学方程式_________________________________。
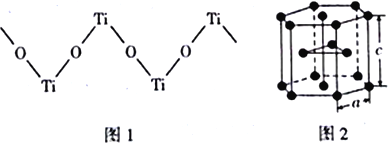
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图1所示,其化学式为_____________。阴离子SO42-中硫原子的杂化方式为______________,写出一种与SO42-互为等电子体的分子_____________。
(5)下图2是钛晶体在空间的一种堆积方式,此堆积方式叫______________,钛原子的配位数为____________。已知:a=0.295 nm,c=0.469nm,则该钛晶体的密度为_________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4).再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
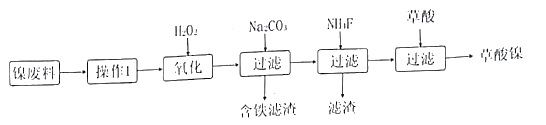
请回答下列问题:
(1)操作I为____。加入H2O2发生的主要反应的离子方程式为_____;加入碳酸钠溶液调节pH至4.0一5.0,其目的为______。
(2)若加入NH4F时滤液中c(Mg2+)=0.02 mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO -,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____。
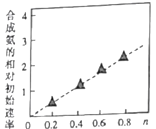
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生电化腐蚀时,负极上发生的反应是( )
A.2H++2e-=H2↑B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+D.4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请据图回答下列问题:
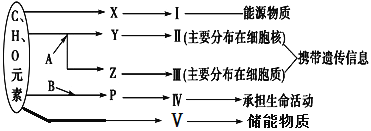
(1)图中A代表的元素是(用元素符号填写)_______________。图中X是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)Ⅴ在动物、植物细胞均含有,是生物体内理想的储能物质,则Ⅴ是_______________。
(3)物质P是_______________,其结构通式为______________________________;若Ⅳ分子由n个P分子(平均相对分子质量为m)组成的2条链组成,则该Ⅳ分子的相对分子质量大约为______________。从理论上分析,该Ⅳ物质至少有_____个氨基和_____个羧基。
(4)生物体中的Ⅱ、Ⅲ的基本组成单位是__________各单位间是通过______________键连接起来的,可以通过___________________________对细胞进行染色,染色后Ⅱ呈现出_______色,Ⅲ呈现出_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有①6.72 L CO2 ②6.02×1023个HCl分子 ③0.1mol NH3 ④4g氢气,请回答:
(1)它们的体积由大到小的顺序为___________________(填写序号,下同);
(2)质量由大到小的顺序为______________________,
(3)密度由大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从起始状态下A出发,在一定条件下可发生一系列变化,由图判断下列关系错误的是( )

A. A→D,ΔH=-ΔH4
B. ΔH1+ΔH2+ΔH3+ΔH4=0
C. A→C,ΔH=ΔH3+ΔH4
D. |ΔH2+ΔH3|=|ΔH1+ΔH4|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com