
 金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.
金属是一种重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中的铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L液态水分解成2L氢气与1L氧气吸收571.6 kJ热量 |
| B、2 mol氢气与1mol氧气反应生成2mol气态水放出热量大于571.6 kJ |
| C、在相同条件下,2 mol氢气与1mol氧气的能量总和大于2mol液态水的能量 |
| D、使用催化剂能降低该反应的活化能使反应放出得热量小于571.6 kJ |
查看答案和解析>>
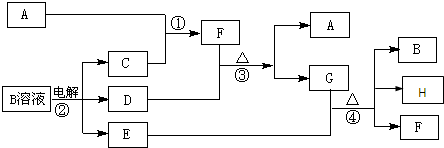
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做中和热测定实验时,若没有环形玻璃搅拌棒,可用环形铜质搅拌棒代替 |
| B、中和滴定实验中,左手调控滴定管的活塞,右手持锥形瓶,眼睛注视滴定管中液面的变化 |
| C、溴蒸汽和二氧化氮两种红棕色气体可用淀粉碘化钾溶液来鉴别 |
| D、除去蛋白质溶液中少量的NaCl,可将装有混合液的半透膜袋浸入流动的蒸馏水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠溶于水:Na+2H2O═Na++2OH-+H2↑ |
| B、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
| C、碳酸钙与盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、硫酸铝溶液与氨水的反应:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
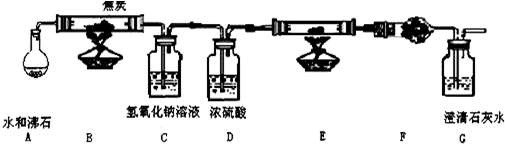
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应开始4 min内温度对反应速率的影响比浓度大 |
| B、一段时间后,反应速率减小的原因是c(H+)减小 |
| C、反应在2~4 min内平均反应速率最大 |
| D、反应在2~4 min内生成CO2的平均反应速率为V(CO2)=0.1 mol?L-1?min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com