
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等.利用炼铝厂的废料﹣铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾.工艺流程如下:
回答下列问题:

(1)明矾净水的原理是(用离子方程表示)________________;
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、________、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是________(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4﹣转化为Mn2+)________________。
已知:生成氢氧化物沉淀的pH如下表所示
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L﹣1
根据表中数据解释调pH=3的目的________________。
(5)已知:在pH=3、加热条件下,MnO4﹣可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为________________________。
【答案】 Al3++3H2O![]() Al(OH3(胶体)+3H+ 过滤 冷却结晶 高锰酸钾酸性溶液 或 铁氰化钾溶液 5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O 使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀 3Mn2++2MnO4﹣+2H2O
Al(OH3(胶体)+3H+ 过滤 冷却结晶 高锰酸钾酸性溶液 或 铁氰化钾溶液 5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O 使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀 3Mn2++2MnO4﹣+2H2O![]() 5MnO2+4H+
5MnO2+4H+
【解析】本题主要考查对于利用炼铝厂的废料﹣铝灰制备明矾的工艺流程的评价。
(1)明矾净水的原理是(用离子方程表示)Al3++3H2O![]() Al(OH3(胶体)+3H+;
Al(OH3(胶体)+3H+;
(2)操作Ⅰ得到滤液和滤渣,操作I是过滤,操作Ⅱ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)可以利用Fe2+的还原性选择高锰酸钾酸性溶液或利用Fe2+可以与铁氰化钾溶液生成蓝色沉淀的性质选择铁氰化钾溶液。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4﹣转化为Mn2+)5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O。
调pH=3的目的是使Fe3+转化成Fe(OH)3沉淀,并防止Al3+沉淀。
(5)已知:在pH=3、加热条件下,MnO4﹣可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为3Mn2++2MnO4﹣+2H2O![]() 5MnO2+4H+。
5MnO2+4H+。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下所示,它在一定条件下可能发生的反应有( )

①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去
A. ②③④ B. ①③④⑤⑥
C. ①③④⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:__________________
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:__________________
(3)已知断裂1 mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1中数据计算断裂1 molN-H键所需的能量(kJ)是:__________________
(4)写出NH3与NaClO反应得到肼的化学方程式:____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三组元素,它们的原子序数分别是①3和9;②17和12;③6和8。
(1)其中能组成XY2型的共价化合物分子的是 __________,电子式是____________________;
(2)能形成XY型离子化合物的是________,电子式是_________________________;
(3)用电子式表示第②组化合物的形成过程________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,能表示反应 2X(g)+2Y(s)![]() Z(g) 一定达到化学平衡状态的是
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A. ①②③⑥ B. ①③④⑤ C. ②③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
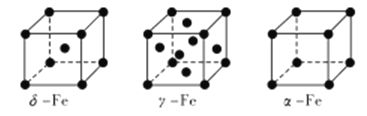
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将下列物质进行分类:①H与D②O2与O3③乙醇(C2H5OH)与甲醚(CH3-O-CH3)④正丁烷与异丁烷⑤C60与金刚石
(1)互为同位素的是_______(填编号、下同);
(2)互为同素异形体的是_______ ;
(3)互为同分异构体的是________;
(II)反应Fe + H2SO4=== FeSO4+ H2↑的能量变化趋势如图所示:
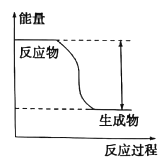
(1)该反应为 _______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B. 改稀硫酸为98%的浓硫酸 C.适当升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。该极上发生的电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。

(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com