
【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。

(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
【答案】 A 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O 当滴入最后一滴溶液,溶液颜色由无色变为浅紫色,且30s内不褪色 0.0475/V1 偏小 Na+>HC2O4->H+>C2O42->OH-
【解析】(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,答案选A;(2)酸性高锰酸钾溶液将草酸(H2C2O4)氧化生成CO2,自身被还原为Mn2+,发生反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点草酸反应完了,稍稍过量的高锰酸钾显紫红色,故判断依据是:当滴入最后一滴溶液,溶液颜色由无色变为浅紫色,且30s内不褪色;(4)三次滴定消耗标准液体积分别为:19.10mL、18.90mL、24.06mL,可见第三次滴定的数据无效,舍去,消耗标准液的平均体积为: ![]() =19.00mL,高锰酸钾的物质的量为:0.001mol/L×0.019L=1.9×10-5mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,n(H2C2O4)=
=19.00mL,高锰酸钾的物质的量为:0.001mol/L×0.019L=1.9×10-5mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,n(H2C2O4)= ![]() n(KMnO4)=4.75×10-5mol,待测液草酸的物质的量浓度为:
n(KMnO4)=4.75×10-5mol,待测液草酸的物质的量浓度为: ![]() =
=![]() molL-1;(5)滴定终点读数时,俯视滴定管刻度,其他操作正确,导致消耗的标准液体积读数偏小,根据c(待测)=
molL-1;(5)滴定终点读数时,俯视滴定管刻度,其他操作正确,导致消耗的标准液体积读数偏小,根据c(待测)= 可知,测定结果偏小;(6)NaHC2O4溶液中草酸氢根离子的电离大于水解,溶液显酸性说明c(H+)>c(OH-),c(Na+)最大, c(HC2O4-)次之, c(H+)>c(C2O42-),因为H+除了来自于HC2O4-的电离,还来自于水的电离,而C2O42-只来自于HC2O4-的电离,c(OH-)最小,则溶液中各离子的浓度按由大到小的顺序排列的是:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。
可知,测定结果偏小;(6)NaHC2O4溶液中草酸氢根离子的电离大于水解,溶液显酸性说明c(H+)>c(OH-),c(Na+)最大, c(HC2O4-)次之, c(H+)>c(C2O42-),因为H+除了来自于HC2O4-的电离,还来自于水的电离,而C2O42-只来自于HC2O4-的电离,c(OH-)最小,则溶液中各离子的浓度按由大到小的顺序排列的是:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等.利用炼铝厂的废料﹣铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾.工艺流程如下:
回答下列问题:

(1)明矾净水的原理是(用离子方程表示)________________;
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、________、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是________(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4﹣转化为Mn2+)________________。
已知:生成氢氧化物沉淀的pH如下表所示
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L﹣1
根据表中数据解释调pH=3的目的________________。
(5)已知:在pH=3、加热条件下,MnO4﹣可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出)。下列有关叙述正确的是( )
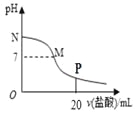
A. M~N间一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M点对应的盐酸体积为10.0mL
C. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. P点处的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A. 甲烷的标准燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ/mol
B. CO(g)的燃烧热是283.0 kJ/mol ,则2CO2(g)=2CO(g)+O2(g)的反应热△H="+2×283.0" kJ/mol
C. NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
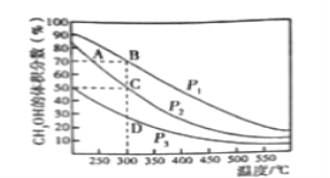
(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1mo/L的NaOH溶液滴入盛有50mL pH= 2的H A溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如下图。下列说法正确的是
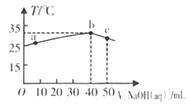
A. a点溶液中,c(A-)+ c(HA)= 0.08mol/L.
B. b点溶液中,c(A-)<c(Na+))
C. b → c的过程中,发生了吸热反应
D. 溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5-有机化学基础]有机物F是一种重要的精细化工合成中间体,其合成线路如图:
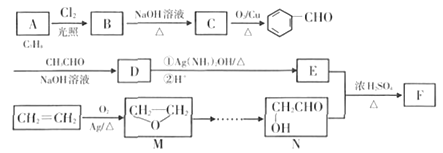
已知: ![]() ,回答下列问题:
,回答下列问题:
(1)有机物A、C的名称分别为______、_____,D![]() E的反应类型为__________。
E的反应类型为__________。
(2)有机物F的结构简式为________。写出B ![]() C反应方程式__________。
C反应方程式__________。
(3)有机物D中含氧官能团的名称为_______,若要证明D中含有“![]() ”官能团,实验方法为_______。
”官能团,实验方法为_______。
(4)E的同分异构体有多种,其中属于芳香族化合物,既能使溴的四氯化碳溶液褪色,又能在氢氧化钠溶液中发生水解反应的同分异构体有__________种。
(5)环氧乙烷(![]() )是一种重要的石化产品,化学性质活泼,能与水、卤化氢、乙醇等很多化合物发生a处开环加成反应。写出由M
)是一种重要的石化产品,化学性质活泼,能与水、卤化氢、乙醇等很多化合物发生a处开环加成反应。写出由M![]() N的合成路线:____________。
N的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”、“摩尔”和“摩尔质量”等的叙述中正确的是( )
A.物质的量是一个基本的物理量,单位是摩尔
B.物质的摩尔质量等于其相对分子(原子)质量
C.0.12 kg 12C中所含的碳原子数为阿伏加德罗常数
D.1 mol任何物质中都含有阿伏加德罗常数个原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com