
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
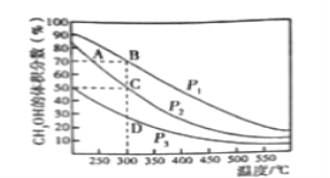
(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
【答案】 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51kJ·mol-1 < > K=48 BC C 保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商![]() ,所以平衡不移动
,所以平衡不移动
【解析】Ⅰ.已知:① CH3OH(g)+H2O(l)=CO2(g)+3H2(g)ΔH=+93.0kJ·mol-1
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
③ CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
根据盖斯定律可知,②×3-①×2-③即得到甲醇的燃烧热的热化学方程式:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-726.51kJ·mol-1,故答案为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-726.51kJ·mol-1;
Ⅱ. (1).据图可知,随着温度的升高,CH3OH的体积分数逐渐减小,说明升高温度,平衡逆向移动,则该反应的正反应为放热反应,△H<0;因该反应的正反应是气体体积减小的反应,则增大压强,平衡正向移动,CH3OH的体积分数增大,即压强越大,CH3OH的体积分数越大,据图可知,压强为P1时CH3OH的体积分数大于压强为P2时CH3OH的体积分数,所以P1>P2,故答案为:<;>;
(2). 压强为P2,温度为300℃时,CH3OH的体积分数为50%,根据三段式法有:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
转化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
![]() ×100%=50%,解得x=0.75mol,则达到平衡时CO、H2、CH3OH的浓度分别为:0.125mol/L、0.25mol/L、0.375mol/L,所以平衡常数K=
×100%=50%,解得x=0.75mol,则达到平衡时CO、H2、CH3OH的浓度分别为:0.125mol/L、0.25mol/L、0.375mol/L,所以平衡常数K=![]() =48,故答案为48;
=48,故答案为48;
(3). A.该反应是反应前后气体体积变化的可逆反应,容器内气体压强不再变化,说明反应达到了平衡状态,故A正确;B.v(CO):c(H2):v(CO3OH)=1:2:1,因未指明是正反应速率还是逆反应速率,则不能说明反应达到了平衡状态,故B错误;C.因容器恒容且反应前后总质量不变,则容器内的密度始终不变,所以容器内的密度不再变化不能说明反应达到了平衡状态,故C错误; D.因该反应的气体总质量不变,而反应前后气体物质的量不相等,所以容器内混合气体的平均相对分子质量不再变化,说明反应达到了平衡状态,故D正确;E.容器内各组分的质量分数不再变化,说明反应达到了平衡状态,故E正确;答案选BC。
(4).某温度下在保证H2浓度不变的情况下,增大容器的体积,则c(CH3OH)与c(CO)同等倍数减小,根据浓度商的表达式![]() 可知,Qc不变,则平衡不移动,故答案为:C;保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商
可知,Qc不变,则平衡不移动,故答案为:C;保证c(H2)不变情况下,增大容器体积,c(CH3OH)与c(CO)同等倍数减小,根据浓度商![]() ,所以平衡不移动。
,所以平衡不移动。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
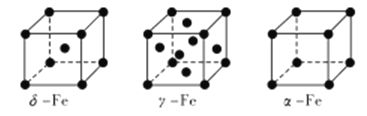
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
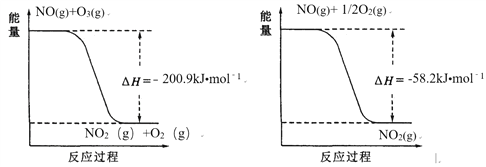
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
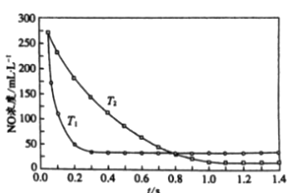
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
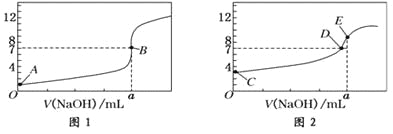
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。

(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
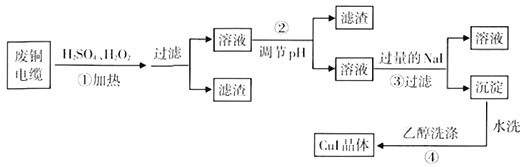
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。
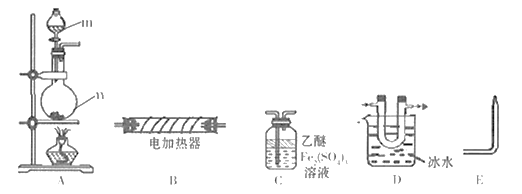
(1)仪器m的名称为_________,装置C名称为____________。
(2)实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3,反应的化学方程式为___________。
(3)用装置A制取PH3,实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是___________。
(4)将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有____性,装置C中发生的化学反应方程式为_________,点燃E处气体的目的为______________。
(5)将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
A![]()
![]() D
D![]()
![]() ______
______![]() E( 在“
E( 在“![]() ”之间的空白处填写装置编号)。
”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是巧克力、蜂蜜香精的配料,其合成路线如下:

已知:
①一个碳原子上同时连接两个羟基,立即失去一分子水,生成另一种物质,如:![]()
②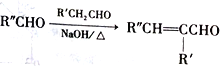
(1)A的化学名称是________________,M中官能团的名称为___________________。
(2)K与H的关系是__________________________。
(3)C分子结构中最多_________个原子共平面。
(4)J的结构简式为__________________________。
(5)G生成H的化学方程式为_______________________________。反应类型为_________________。
(6)同时满足下列条件的E的同分异构体共有__________________种。
①能与FeCl3溶液显紫色 ②能发生银镜反应 ③能与溴水发生加成反应而褪色
(7)以对二甲苯与乙醛为原料,结合已知信息选用必要的无机物合成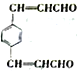 ,设计合理的合成路线:______________________________________。合成流程图示例如下:CH2=CH2
,设计合理的合成路线:______________________________________。合成流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com