
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
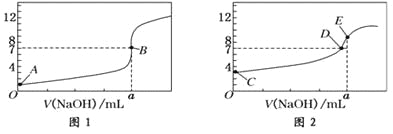
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
【答案】B
【解析】试题分析:A.滴定开始时,0.1000molL-1盐酸pH=1,0.1000molL-1醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;B.达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;C.达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C错误;D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误;故选B。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
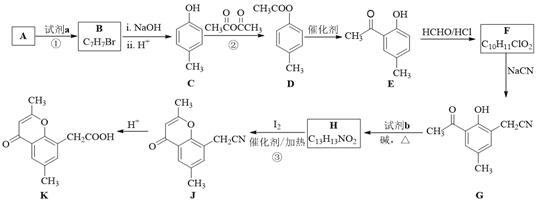
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
已知部分有机化合物转化的反应式如下:
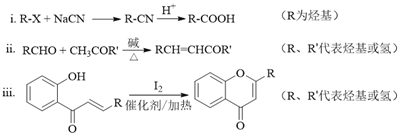
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)C→D的化学方程式是______。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:______。
a.能发生银镜反应
b.分子中含有酯基
c. 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是______;试剂b是______。
(5)H与I2反应生成J和HI的化学方程式是______。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线。_____________
),参照下列模板写出相应的合成路线。_____________
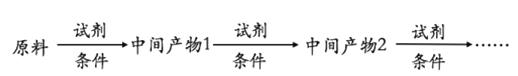
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
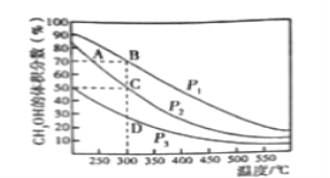
(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3
B. 500℃左右比通常状况下更有利于合成氨
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com