
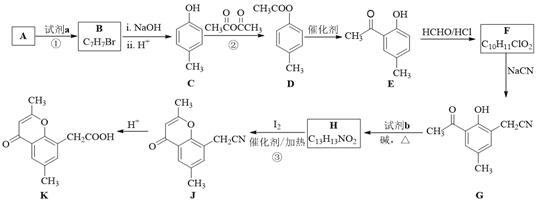
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
已知部分有机化合物转化的反应式如下:
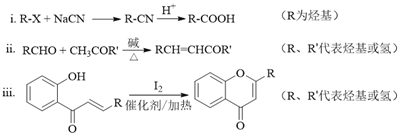
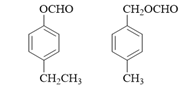
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)C→D的化学方程式是______。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:______。
a.能发生银镜反应
b.分子中含有酯基
c. 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是______;试剂b是______。
(5)H与I2反应生成J和HI的化学方程式是______。
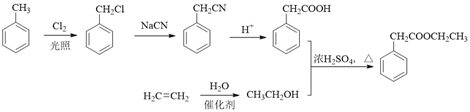
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线。_____________
),参照下列模板写出相应的合成路线。_____________
【答案】 ![]() 取代反应
取代反应 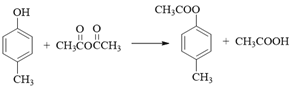
 CH3CHO(乙醛)
CH3CHO(乙醛) 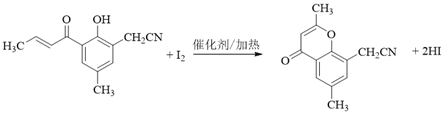
【解析】(1). A的分子式是C7H8,结合合成路线可知,A为甲苯,其结构简式为![]() ,由C的结构式可知,B为
,由C的结构式可知,B为![]() ,则
,则![]() 与溴发生取代反应生成B,故答案为:
与溴发生取代反应生成B,故答案为:![]() ;取代反应;
;取代反应;
(2). C为![]() ,与
,与![]() 发生反应生成D, 化学方程式为:
发生反应生成D, 化学方程式为: ,故答案为:
,故答案为: ;
;
(3). 分子中含有酯基且能发生银镜反应,说明分子中含有甲酸形成的酯基,苯环上有两个取代基,且苯环上的一氯代物有两种,说明两个取代基处于苯环的对位,符合条件的有: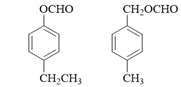 ,故答案为:
,故答案为: ;
;
(4). 由题目信息i并结合G的结构式可知,F的结构简式为: ,根据G和H的分子式并结合信息ii可知,试剂b为乙醛,故答案为:
,根据G和H的分子式并结合信息ii可知,试剂b为乙醛,故答案为: ;CH3CHO(乙醛);
;CH3CHO(乙醛);
(5). 根据信息iii可知,H与I2反应生成J和HI的化学方程式是: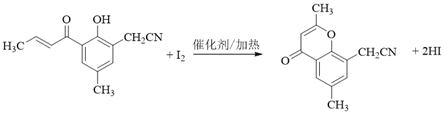 ,故答案为:
,故答案为: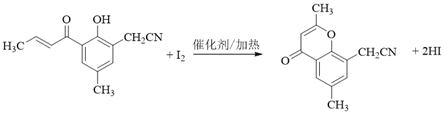 ;
;
(6). 根据题中信息,合成苯乙酸乙酯时,可用甲苯与Cl2在光照条件下发生取代反应生成![]() ,
,![]() 与NaCN反应生成
与NaCN反应生成![]() ,在酸性条件下生成
,在酸性条件下生成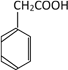 ,再利用乙烯与水发生加成反应生成乙醇,乙醇与
,再利用乙烯与水发生加成反应生成乙醇,乙醇与 发生酯化反应生成苯乙酸乙酯,合成路线为:
发生酯化反应生成苯乙酸乙酯,合成路线为: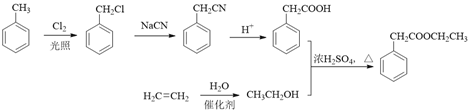 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是
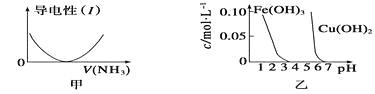

A. 图甲表示向盐酸溶液中通入NH3过程中溶液导电性的变化
B. 由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右
C. 图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
D. 图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
A.蒸馏石油 | B.除去甲烷中少量乙烯 | C.验证化学能转变电能 | D.制取乙酸乙酯 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学研究的正确说法是( )
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 从HF、HCl、HBr、HI酸性递增的事实,推出F、、Cl、Br、I的非金属递增的规律
C. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
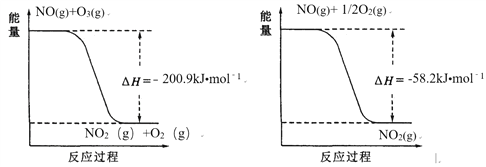
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
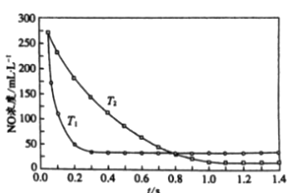
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是

A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
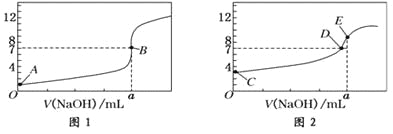
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Hagemann酯的合成路线如下(部分反应条件略去):

(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com