
����Ŀ��NOx����ɴ�����Ⱦ���ڹ�ҵ�ϲ��ö��ַ������д�����
I.�������������е�NO��O3Ԥ������ת��ΪNO2������CaSO3����Һ����NO2��
��֪�������£�CaSO4�ij����ܽ�ƽ�ⳣ����ֵΪ9.1��10-6��CaSO3�ij����ܽ�ƽ�ⳣ����ֵΪ3.1��10-7��
��1��NO��O3��Ӧ���̵������仯���£�
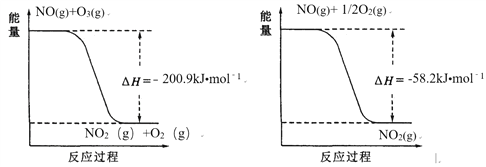
NO��O3�������ܷ�Ӧ�ǻ��Ϸ�Ӧ���÷�Ӧ���Ȼ�ѧ����ʽΪ ________��
��2����CaSO3����Һ���ã�ȡ�ϲ���Һ�����pHԼΪ8���û�ѧ���������ԭ��Ϊ________��
��3����CaSO3����Һ����NO2������ת��ΪHNO2���÷�Ӧ�Ļ�ѧ����ʽΪ________��
��4����ʵ������NO2�Ĺ����У�ͨ����CaSO3����Һ�м���Na2SO4���壬���NO2���������ʣ����ܽ�ƽ��ĽǶȽ�����ԭ����________��
II. ѡ���ԷǴ���ԭ�����÷�Ӧ��ʹ�ô������������ڸ�������������NH3����ԭ���� NOx ����ѡ���Է�Ӧ��4NH3 + 4NO + O2 ![]() 3N2 + 6H2O����ͬ�¶ȣ�T���£���Ӧʱ�䣨t����NOŨ�ȵĹ�ϵ����ͼ��ʾ��
3N2 + 6H2O����ͬ�¶ȣ�T���£���Ӧʱ�䣨t����NOŨ�ȵĹ�ϵ����ͼ��ʾ��
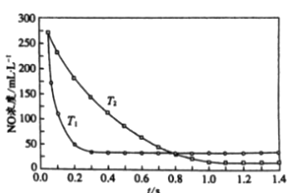
��5���жϸ÷�ӦΪ________��������������������������Ӧ��˵��������________ ��
���𰸡� 3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1 SO32- + H2O
3NO2(g) ��H= -317.3 kJmol��1 SO32- + H2O ![]() HSO3- + OH- CaSO3 + 2NO2 + H2O
HSO3- + OH- CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4 CaSO3��Һ�д�����CaSO3(s)
2HNO2 + CaSO4 CaSO3��Һ�д�����CaSO3(s) ![]() Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ� ���� ��ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ
Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ� ���� ��ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ
��������I. (1). ����ͼ��֪��NO��O3��Ӧ����NO2��O2���Ȼ�ѧ����ʽΪ��NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200.9kJ/mol ��������ͼ��֪��NO��O2��Ӧ����NO2���Ȼ�ѧ����ʽΪ��NO(g)��![]() O2(g)=NO2(g) ��H=��58.2kJ/mol ������+2���ڵ�3NO(g) + O3(g)
O2(g)=NO2(g) ��H=��58.2kJ/mol ������+2���ڵ�3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1���ʴ�Ϊ��3NO(g) + O3(g)
3NO2(g) ��H= -317.3 kJmol��1���ʴ�Ϊ��3NO(g) + O3(g) ![]() 3NO2(g) ��H= -317.3 kJmol��1��
3NO2(g) ��H= -317.3 kJmol��1��
(2). CaSO3��ǿ�������Σ�SO32������Һ�з���ˮ�ⷴӦ��SO32- + H2O ![]() HSO3- + OH-��ʹ��Һ�ʼ��ԣ��ʴ�Ϊ��SO32- + H2O
HSO3- + OH-��ʹ��Һ�ʼ��ԣ��ʴ�Ϊ��SO32- + H2O ![]() HSO3- + OH-��
HSO3- + OH-��
(3). ��CaSO3����Һ����NO2������ת��ΪHNO2����Ԫ�صĻ��ϼ۴�+4�۽��͵�+3��������Ԫ�صĻ��ϼ۴�+4�����ߵ�+6����SO32������SO42�������ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�Ļ�ѧ����ʽΪ��CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4���ʴ�Ϊ��CaSO3 + 2NO2 + H2O
2HNO2 + CaSO4���ʴ�Ϊ��CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4��
2HNO2 + CaSO4��
(4). ��CaSO3��Һ�д����ܽ�ƽ����CaSO3(s) ![]() Ca2+(aq) + SO32-(aq)
Ca2+(aq) + SO32-(aq)![]() Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ���
Ca2+(aq) + SO32-(aq)������Na2SO4����������CaSO4��Ksp��С��SO42-��Ca2+�������CaSO4������c(Ca2+)��С��ƽ�������ƶ�������c(SO32-)�������Ӷ�ʹNO2���������ʼӿ���
II. (5). ��ͼ��֪����T1�¶��·�Ӧ�ȴﵽƽ��״̬��˵��T1>T2������ʱNO��ƽ��Ũ�ȸߣ�˵���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ʴ�Ϊ�����ȣ���ͼ����T1�·�Ӧ�ȴ�ƽ����ƶ�T1>T2����T1�����£�ʱNO��ƽ��Ũ�ȸ߿��ƶ�����Ӧ�Ƿ��ȷ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����볣��(Ka��Kb)���ܶȻ�����(Ksp)���ж��������ʵ���Ҫ���������й�����Щ�����ļ����������ȷ���ǣ� ��
A. ij��������ҺpH=4.3�������Զ������룬����һ������ƽ�ⳣ��K1=1.0��10-8.60
B. Ka(HCN)<Ka(CH3COOH)��˵��ͬŨ��ʱ����������Աȴ���ǿ
C. Ksp(AgI)<Ksp(AgCl)����AgCl����Һ�м���KI��Һ����ֻ�ɫ����
D. Ksp(AgCl)<Ksp(AgOH)��˵��AgOH��AgCl��������ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A. �����£���ˮ�м������������������ƣ�c(H+)����Kw���
B. 0.1 mol��L-1�Ĵ����ˮϡ�ͣ�c(CH3COOH)/c(CH3COO��)��С����K������
C. ���������pH����ͬ�Ĵ����������ȫ�ܽ������þ�ۣ�������������ʱ��
D. 25������AgCl����Һ�м�������NaCl������c(Ag+)��С��Ksp(AgCl)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
(��)ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
���������ʵ����Ʊ�������ʵ��Ŀ��һ������գ�
ʵ�� ��� | �¶� ���棩 | ����ʯ ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
�� | 25 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 (II)ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ͢�̽��______________�Է�Ӧ���ʵ�Ӱ�� |
�� | 25 | �ֿ��� | _______ | |
�� | _____ | �ֿ��� | 2.00 | |
�� | 25 | ϸ���� | 2.00 |
(��)��2.5 mol A��2.5 mol B��Ϸ���2 L�ܱ������������Ӧ��3A(g)��B(g)![]() xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
��1����ƽ��ʱB��ת����Ϊ_____________________��
��2��x��ֵΪ___________________��
��3�����¶Ȳ��䣬��ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��____________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.0 mL 0.10 mol/L��ˮ�е���0.10 mol/L�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ(�����������ݳ�)�������й�������ȷ����( )
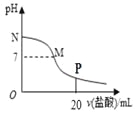
A. M��N��һ�����ڣ�c(Cl��)>c(NH4+)>c(OH��)>c(H+)
B. M���Ӧ���������Ϊ10.0mL
C. pH=7����Һ�У�c(NH4+)=c(Cl��)=c(H+)=c(OH��)
D. P�㴦����Һ�д��ڣ�2c(NH4+)+2c(NH3��H2O)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������������õĻ�ͪ���������L�ĺϳ�·������ͼ��ʾ��
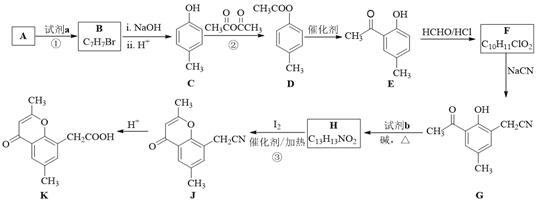
��֪�����л�������ת���ķ�Ӧʽ���£�
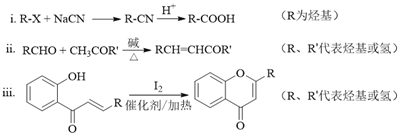
��1��A�ķ���ʽ��C7H8����ṹ��ʽ��______��A��B�����ķ�Ӧ����Ϊ______��
��2��C��D�Ļ�ѧ����ʽ��______��
��3��д����������������D������һ��ͬ���칹��Ľṹ��ʽ��______��
a.�ܷ���������Ӧ
b.�����������
c. ������������ȡ�������ұ����ϵ�һ�ȴ���������
��4��F�Ľṹ��ʽ��______���Լ�b��______��
��5��H��I2��Ӧ����J��HI�Ļ�ѧ����ʽ��______��
��6����A����ϩΪ��ʼԭ�ϣ����������Ϣ��ѡ�ñ�Ҫ�����Լ��ϳɱ�����������![]() ������������ģ��д����Ӧ�ĺϳ�·�ߡ�_____________
������������ģ��д����Ӧ�ĺϳ�·�ߡ�_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ������������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe(OH)3���壬Fe(OH)3��������������ã�������ˮ�е������ʹ�������������ˮ�����ã���ԭ����ͼ��ʾ������˵����ȷ����

A��ʯī�缫�Ϸ���������Ӧ
B������ͼʾ������AΪCO2
C��Ϊ��ǿ��ˮ�ĵ���������������ˮ�м��������Ҵ�
D������ȼ�ϵ����CO32�������һ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֣��翪�����������Դ���״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����
��.��֪����CH3OH��g��+H2O��l��=CO2��g��+3H2��g�� ��H=+93.0kJ��mol��1
��CH3OH(g)��1/2O2(g)=CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
��CH3OH(g)=CH3OH(l) ��H����38.19 kJ��mol��1
���ʾCH3OH��ȼ���ȵ��Ȼ�ѧ����ʽΪ______________________________________________��
��.��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��![]() CH3OH��g������2L�����ܱ������г���1mol CO��2molH2���ڴ��������³�ַ�Ӧ����ͼ��ʾƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ƽ�����ߡ��ش��������⣺
CH3OH��g������2L�����ܱ������г���1mol CO��2molH2���ڴ��������³�ַ�Ӧ����ͼ��ʾƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ƽ�����ߡ��ش��������⣺
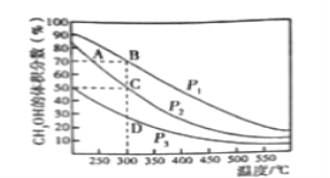
��1���÷�Ӧ�ķ�Ӧ����H_______0������>������<������ѹǿ����Դ�С��p1_______p2������>������<������
��2��ѹǿΪp2���¶�Ϊ300��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=________________��
��3�����и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ�����________________________________��
A������������ѹǿ���ٱ仯 B��v��CO����c��H2����v��CO3OH��=1:2:1
C�������ڵ��ܶȲ��ڱ仯 D�������ڻ�������ƽ����Է����������ٱ仯
E.�����ڸ���ֵ������������ٱ仯
��4��ij�¶����ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��_________������ĸ����
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
�������жϵ�������__________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2X ��H2Y��Ϊ��Ԫ����������������NaOH ��Һ�ֱ�ӵ�H2X ��H2Y����Һ�����ڲ�ͬpH �����²�ͬ��̬�����������ᡢ��ʽ������������������ɷ�����ͼ��ʾ��
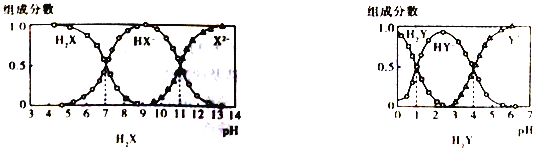
����˵����ȷ����
A. ��pH=7����Һ��HX-��X2-��HY-��Y2-�ܴ�������
B. ��Na2X��Һ�м�������H2Y ��Һ��������Ӧ��X2-+H2Y==HX-+HY-
C. 1L.0.1mol��L-1NaHY��Һ��n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-��ˮ��ƽ�ⳣ��ΪKb=10-7
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com