
【题目】下列说法正确的是( )
A. 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
B. 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO-)减小,但K不变。
C. 足量体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D. 25℃,在AgCl悬浊液中加入少量NaCl固体,c(Ag+)减小,Ksp(AgCl)减小
【答案】B
【解析】A项,H2O的电离方程式为H2O![]() H++OH-,加入NaHSO4固体,NaHSO4在水溶液中电离出Na+、H+、SO42-,c(H+)增大,但温度不变,KW不变,错误;B项,醋酸溶液加水稀释促进醋酸的电离,n(CH3COO-)增大,n(CH3COOH)减小,
H++OH-,加入NaHSO4固体,NaHSO4在水溶液中电离出Na+、H+、SO42-,c(H+)增大,但温度不变,KW不变,错误;B项,醋酸溶液加水稀释促进醋酸的电离,n(CH3COO-)增大,n(CH3COOH)减小,![]() =
=![]() 减小,由于温度不变,K不变,正确;C项,开始瞬间pH相同,开始瞬间醋酸和盐酸与镁粉反应速率相等,醋酸属于弱酸,存在电离平衡,后来镁粉与H+反应促进醋酸的电离,醋酸溶液中c(H+)大于盐酸中c(H+),镁粉与醋酸反应快,醋酸用时少,错误;D项,在AgCl悬浊液中存在溶解平衡:AgCl(s)
减小,由于温度不变,K不变,正确;C项,开始瞬间pH相同,开始瞬间醋酸和盐酸与镁粉反应速率相等,醋酸属于弱酸,存在电离平衡,后来镁粉与H+反应促进醋酸的电离,醋酸溶液中c(H+)大于盐酸中c(H+),镁粉与醋酸反应快,醋酸用时少,错误;D项,在AgCl悬浊液中存在溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),加入少量NaCl电离出Cl-,c(Cl-)增大,溶解平衡逆向移动,c(Ag+)减小,温度不变,Ksp(AgCl)不变,错误;答案选B。
Ag+(aq)+Cl-(aq),加入少量NaCl电离出Cl-,c(Cl-)增大,溶解平衡逆向移动,c(Ag+)减小,温度不变,Ksp(AgCl)不变,错误;答案选B。


科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三组元素,它们的原子序数分别是①3和9;②17和12;③6和8。
(1)其中能组成XY2型的共价化合物分子的是 __________,电子式是____________________;
(2)能形成XY型离子化合物的是________,电子式是_________________________;
(3)用电子式表示第②组化合物的形成过程________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
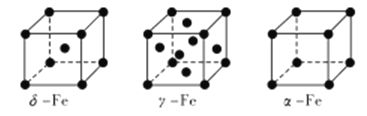
① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
A.蒸馏石油 | B.除去甲烷中少量乙烯 | C.验证化学能转变电能 | D.制取乙酸乙酯 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将下列物质进行分类:①H与D②O2与O3③乙醇(C2H5OH)与甲醚(CH3-O-CH3)④正丁烷与异丁烷⑤C60与金刚石
(1)互为同位素的是_______(填编号、下同);
(2)互为同素异形体的是_______ ;
(3)互为同分异构体的是________;
(II)反应Fe + H2SO4=== FeSO4+ H2↑的能量变化趋势如图所示:
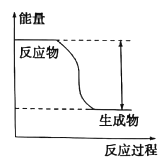
(1)该反应为 _______反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是______(填字母)。
A.改铁片为铁粉 B. 改稀硫酸为98%的浓硫酸 C.适当升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____(填“正”或“负”)极。该极上发生的电极反应为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
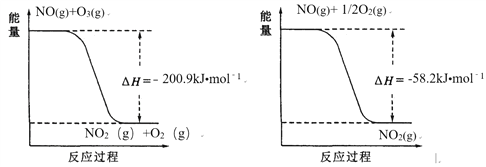
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
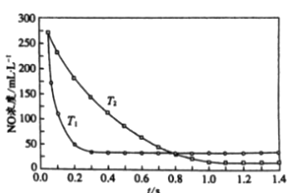
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
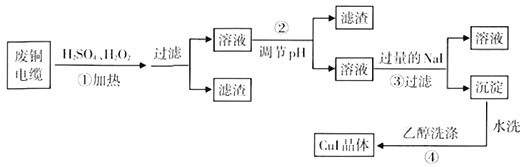
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com