
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
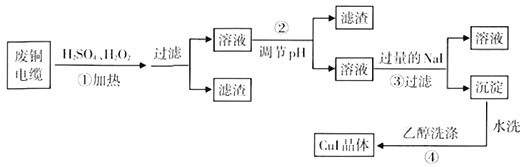
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
【答案】 Cu+H2O2+H2SO4![]() CuSO4+2H2O 温度高于40℃时,H2O2分解,浓度减小,反应速率减慢 CD 4.2 2Cu2++4I-=2CuI↓+I2 先去晶体表面的水份或得到干燥的CuI
CuSO4+2H2O 温度高于40℃时,H2O2分解,浓度减小,反应速率减慢 CD 4.2 2Cu2++4I-=2CuI↓+I2 先去晶体表面的水份或得到干燥的CuI ![]()
【解析】试题分析:(1)过程①得到的溶液呈蓝色,说明Cu、H2O2、H2SO4反应生成CuSO4;
温度高于40℃时,H2O2分解,浓度减小;(2)过程②调节溶液pH的目的是除去Cu2+中的Fe3+;Fe(OH)3的Ksp=4×10-35计算完全除去Fe3+时的PH;(3)过程③的氧化产物能使淀粉变蓝,说明氧化产物是I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份;(5)根据关系式CuI![]() Fe2(SO4)3
Fe2(SO4)3![]()
![]() KMnO4计算CuI的质量分数;
KMnO4计算CuI的质量分数;
解析:(1)过程①得到的溶液呈蓝色,说明Cu、H2O2、H2SO4反应生成CuSO4,反应方程式为Cu+H2O2+H2SO4![]() CuSO4+2H2O;温度高于40℃时,H2O2分解,浓度减小,所以反应速率减慢;(2) A、加入NaOH 引入新杂质Na+,故A错误; B.加入NH3·H2O引入新杂质NH4+,故B错误; C.加入CuO ,消耗氢离子,不引入杂质离子,故C正确; D. 加入CuCO3消耗氢离子,不引入杂质离子,故D正确;完全除去Fe3+时
CuSO4+2H2O;温度高于40℃时,H2O2分解,浓度减小,所以反应速率减慢;(2) A、加入NaOH 引入新杂质Na+,故A错误; B.加入NH3·H2O引入新杂质NH4+,故B错误; C.加入CuO ,消耗氢离子,不引入杂质离子,故C正确; D. 加入CuCO3消耗氢离子,不引入杂质离子,故D正确;完全除去Fe3+时![]() ,
, ![]() ,
, ![]() ,
, 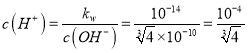 ,PH=-
,PH=- ![]() =4.2;(3)硫酸铜与碘化钠反应的氧化产物能使淀粉变蓝,说明氧化产物是I2,反应离子方程式是2Cu2++4I-=2CuI↓+I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份,得到干燥的CuI;(5)设样品中CuI的质量为xg,根据关系式
=4.2;(3)硫酸铜与碘化钠反应的氧化产物能使淀粉变蓝,说明氧化产物是I2,反应离子方程式是2Cu2++4I-=2CuI↓+I2;(4) CuI不溶于乙醇,乙醇易挥发可以除去晶体表面的水份,得到干燥的CuI;(5)设样品中CuI的质量为xg,根据关系式
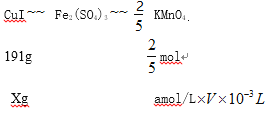
X=191g![]() amol/L
amol/L ![]()
![]() ;样品中CuI的质量分数为191g
;样品中CuI的质量分数为191g![]() amol/L
amol/L 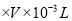
![]()
![]() =
=![]()


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
B. 0.1 mol·L-1的醋酸加水稀释,c(CH3COOH)/c(CH3COO-)减小,但K不变。
C. 足量体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少
D. 25℃,在AgCl悬浊液中加入少量NaCl固体,c(Ag+)减小,Ksp(AgCl)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A.石墨电极上发生氧化反应
B.根据图示,物质A为CO2
C.为增强污水的导电能力,可向污水中加入适量乙醇
D.甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
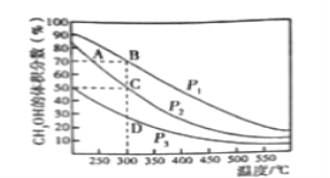
(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1mo/L的NaOH溶液滴入盛有50mL pH= 2的H A溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如下图。下列说法正确的是
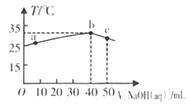
A. a点溶液中,c(A-)+ c(HA)= 0.08mol/L.
B. b点溶液中,c(A-)<c(Na+))
C. b → c的过程中,发生了吸热反应
D. 溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3
B. 500℃左右比通常状况下更有利于合成氨
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5-有机化学基础]有机物F是一种重要的精细化工合成中间体,其合成线路如图:
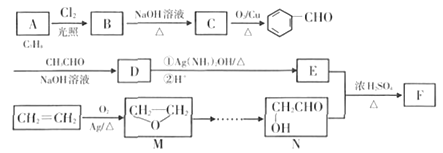
已知: ![]() ,回答下列问题:
,回答下列问题:
(1)有机物A、C的名称分别为______、_____,D![]() E的反应类型为__________。
E的反应类型为__________。
(2)有机物F的结构简式为________。写出B ![]() C反应方程式__________。
C反应方程式__________。
(3)有机物D中含氧官能团的名称为_______,若要证明D中含有“![]() ”官能团,实验方法为_______。
”官能团,实验方法为_______。
(4)E的同分异构体有多种,其中属于芳香族化合物,既能使溴的四氯化碳溶液褪色,又能在氢氧化钠溶液中发生水解反应的同分异构体有__________种。
(5)环氧乙烷(![]() )是一种重要的石化产品,化学性质活泼,能与水、卤化氢、乙醇等很多化合物发生a处开环加成反应。写出由M
)是一种重要的石化产品,化学性质活泼,能与水、卤化氢、乙醇等很多化合物发生a处开环加成反应。写出由M![]() N的合成路线:____________。
N的合成路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:
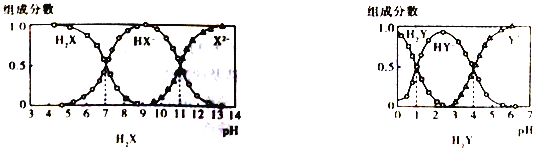
下列说法正确的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常数为Kb=10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.化学用语具有简便、确切地表达化学知识和化学科学思维的特点.下列化学用语中书写正确的是( )
A. N2的电子式:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型 :![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com