
【题目】Hagemann酯的合成路线如下(部分反应条件略去):

(1)Hagemann酯的分子式为_____________。
(2)已知A→B、B→C均为加成反应,则B的结构简式是__________。
(3)E→F的化学方程式是_______________。
(4)已知Hagemann酯的一种同分异构体有下列结构特征:
①含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为____________。
(5)下列说法正确的是________________。
①G为芳香族化合物
②A能和HCl加成得到聚氯乙烯的单体
③G与NaOH溶液共热,能得到甲醇
④在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应
【答案】 C10H14O3 CH2=CH-C≡CH CH3C≡CCOOH+CH3CH2OH![]() CH3C≡CCOOCH2CH3+H2O
CH3C≡CCOOCH2CH3+H2O 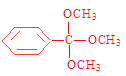 ②④
②④
【解析】试题分析:(1)根据Hagemann酯的分子结构简式可知其分子式为C10H14O3;(2)已知A→B、B→C均为加成反应,则2个分子的乙炔发生加成反应,一个乙炔分子断裂C—H键;另一个乙炔分子断裂碳碳三键中较获得一个键变为碳碳双键,则反应产生的B的结构简式是CH2=CH-C≡CH;(3)根据物质的转化关系可知,E是CH3C≡CCOOH,E分子中含有羧基,可以与乙醇在浓硫酸存在时,在加热条件下发生置换反应,形成酯CH3C≡CCOOCH2CH3和水,则E→F的化学方程式是CH3C≡CCOOH+CH3CH2OH![]() CH3C≡CCOOCH2CH3+H2O;(4)①Hagemann酯的一种同分异构体的结构是:含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为
CH3C≡CCOOCH2CH3+H2O;(4)①Hagemann酯的一种同分异构体的结构是:含有苯环且苯环上只有一个取代基;②除苯环外核磁共振氢谱吸收峰只有1个;③存在甲氧基(-OCH3)。则该同分异构体的结构简式为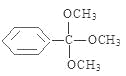 ;(5)①G中无苯环,因此不是芳香族化合物,错误;②A含有碳碳三键,能和HCl加成得到氯乙烯,氯乙烯是聚氯乙烯的单体,正确;③G含有酯基,与NaOH溶液共热,酯基水解可以得到乙醇,不能得到甲醇,错误;④由于一个酯中含有2个碳碳双键,所以在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应,正确。
;(5)①G中无苯环,因此不是芳香族化合物,错误;②A含有碳碳三键,能和HCl加成得到氯乙烯,氯乙烯是聚氯乙烯的单体,正确;③G含有酯基,与NaOH溶液共热,酯基水解可以得到乙醇,不能得到甲醇,错误;④由于一个酯中含有2个碳碳双键,所以在Ni催化下,1molHagemann酯最多能与2 mol H2发生加成反应,正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
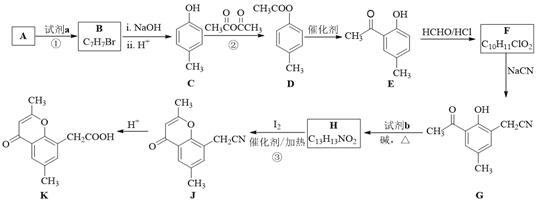
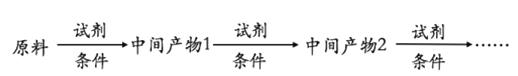
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
已知部分有机化合物转化的反应式如下:
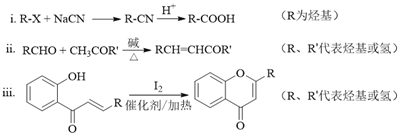
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)C→D的化学方程式是______。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:______。
a.能发生银镜反应
b.分子中含有酯基
c. 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是______;试剂b是______。
(5)H与I2反应生成J和HI的化学方程式是______。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线。_____________
),参照下列模板写出相应的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3
B. 500℃左右比通常状况下更有利于合成氨
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化,其中A是单质。
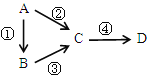
(1)若C是淡黄色固体常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时与CO2反应的化学方程式为_______________________;其中还原剂是________,氧化产物是___________,7.8g C参加反应时转移的电子数是___________。
(2)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此写出A元素的原子结构示意图是______。请写出A用于焊接铁轨的化学方程式___________________________。请写出②的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:
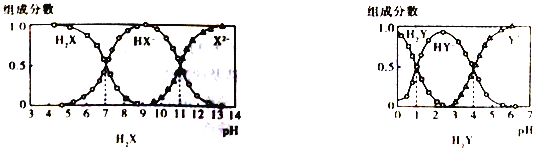
下列说法正确的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常数为Kb=10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13 mol·L-1
B. 所得溶液中由水电离产生的c(H+)=1.0×10-13 mol·L-1
C. 所加的烧碱溶液pH=13.0
D. 所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某些金属离子形成相应氢氧化物时的相关PH值见下表:
难溶物质 | Cu(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
0.1mol/L的金属离子 开始沉淀时PH值 | 4.8 | 1.9 | 3.4 | 9.1 |
完全沉淀(C≦10-5)时PH值 | 6.7 | 3.2 | 4.7 | 11.2 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到较纯的CuCl2·2H2O晶体,可加入______________,调节溶液PH 值至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀。过滤后,将所得滤液经过(填简要实验操作) __________、_________,可得CuCl2·2H2O晶体。
(2)若在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,其原因是______________________________________(用化学方程式表示)。则由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________。(填写简要的实验步骤或操作)
(3)某学习小组用一定浓度的NaOH溶液作为上述某些金属离子分离时的PH控制试剂,为此需准确滴定其浓度,现用已知浓度0.200 mol/L的标准盐酸进行滴定。请回答:
①取0.200 mol/L的标准盐酸来滴定时,以下操作引起NaOH浓度偏小的是______
A.开始滴定时滴定管尖嘴处留有气泡,滴定后气泡消失
B.指示剂变色即停止滴定,溶液又很快(半分钟内)恢复原色
C.滴定开始时仰视读数,滴定终点时俯视,其余操作正常
D.取用碱液前锥形瓶用蒸馏水洗涤后未风干,其余操作正常
②小组中有同学用另一方法计算出了所用NaOH溶液浓度:取100.00 ml 待测NaOH溶液,向内加入0.200 mol/L的标准盐酸50.00 ml,充分反应后,向所得溶液中加入足量铁粉,收集到标准状况下的气体67.2 ml,则该同学所测得原NaOH溶液在常温下的PH值为____________ (结果保留1位小数,已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com