
【题目】用NA表示阿伏伽德罗常数的值。下列叙述正确的是
A. 22.4L乙烷中含有的共价键数为7NA个
B. 常温下,28g乙烯和丙烯的混合物中总原子数为6NA个
C. 密闭容器中2 molNO与1molO2充分反应,产物的分子数为2NA
D. 标准状况下,11.2L二氯甲烷(CH2Cl2)所含的分子数为0.5NA
【答案】B
【解析】A、没有标准状况,气体摩尔体积没有具体值,无法计算乙烷的物质的量;
B.乙烯与丙烯的最简式均为CH2,计算28gCH2中含有的碳原子数目;
C.一氧化氮和氧气反应生成二氧化氮,NO2和N2O4之间存在转化,方程式2NO2 N2O4;
D.标准状况下二氯甲烷(CH2Cl2)不是气体;
详解:A、没有标准状况,气体摩尔体积没有具体值,无法计算乙烷的物质的量,故A错误;
B.常温常压下,28g乙烯与丙烯的混合气体中CH2物质的量![]() =2mol,含有的总原子数为6NA,故B正确;
=2mol,含有的总原子数为6NA,故B正确;
C.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2 N2O4,所以产物分子数小于2NA,所以C选项是错误的;
D.标准状况下CH2Cl2不是气体, 11.2LCH2Cl2物质的量不是0.5mol,故D错误。
所以B选项是正确的。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.2Al+Fe2O3![]() Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
(1)氧元素在元素周期表中的位置为_______________,其离子结构示意图为__________。
(2)铝盐常用作净水剂,用文字和化学用语进行解释_______________________________。
(3)氧的非金属性强于氮,用元素周期律知识分析原因_____________________________。
(4)Al2O3与NaOH溶液反应的离子方程式为______________________________________。
II.NH4Al(SO4)2·12H2O水溶液呈_____性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c(NH4+)_____c(Al3+)(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2、NO3的反应。资料: [Fe(NO)]2+在溶液中呈棕色。

(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。

产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2、NO3的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L1的NaNO3溶液与1 mol·L1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐. 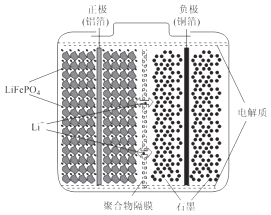
(1)电池工作时的总反应为:LiFePO4+6C ![]() Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
Li1﹣xFePO4+LixC6 , 则放电时,正极的电极反应式为 . 充电时,Li+迁移方向为(填“由左向右”或“由右向左”),图中聚合物隔膜应为(填“阳”或“阴”)离子交换膜.
(2)用该电池电解精炼铜.若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为(保留小数点后一位). (已知:法拉第常数F=96500C/mol,电流利用效率= ![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是

A. MOH为弱碱,HA为强酸
B. 水的电离程度:X=Z>Y
C. 若升高温度,Y、Z点对应溶液的pH均不变
D. 将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:

(1)反应Ⅰ和反应Ⅱ的平衡常数随温度变化曲线如图所示。则△H1________△H2(填“>”、“<”或“=”);△H3=________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:

①温度升高,K值________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值________ (填“增大”“减小”或“不变”),对生成乙醇________ (填“有利”或“不利”)
③在700K、氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。

①阴极的电极反应式为________________。
②从电解后溶液中分离出乙醇的操作方法为________________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________ (填序号)

①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、锌等金属与H2O2可形成“金属-H2O2”电池,能为潜水器提供动力,可用食盐水作为电解质溶液,如下图所示。下列有关Zn-H2O2电池的说法正确的是

A. 电流从Zn电极沿导线流向Pt电极
B. Pt为正极,电极反应为:H2O2+2e-=2OH-
C. 每消耗6.5gZn,将反应0.05molH2O2
D. 食盐水中Cl-向Pt电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图一所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。图二为利用H2S废气资源回收能量并得到单质硫的质子膜燃料电池。下列说法一定正确的是
Fe2++Cr3+。图二为利用H2S废气资源回收能量并得到单质硫的质子膜燃料电池。下列说法一定正确的是

A. 图一电池放电时,C1-从负极穿过选择性透过膜移向正极
B. 图一电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol/L
C. 用图二电池给图一装置充电时,图二中电极a接图一的正极
D. 用图二电池给图一装置充电时,每生成1molS2(s),图一装置中就有4molCr3+被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com