
【题目】某小组研究溶液中Fe2+与NO2、NO3的反应。资料: [Fe(NO)]2+在溶液中呈棕色。

(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。

产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2、NO3的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L1的NaNO3溶液与1 mol·L1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
【答案】 KSCN 两个实验过程均有O2但NaNO3溶液中无明显变化 NO2+e+H2O== NO↑+2OH 证实Fe2+被NO2氧化生成Fe3+ 将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色将NO通入Fe2(SO4)3溶液中无明显变化 棕色溶液中的[Fe(NO)]2+受热生成Fe2+加热有利于Fe2+被氧化为Fe3+促进Fe3+水解产生Fe(OH)3沉淀 ①Fe2++NO2+2CH3COOH== Fe3++NO↑+H2O+2CH3COO Fe2++NO== [Fe(NO)]2+ 两层液体界面上H+NO3与Fe2+反应生成棕色的[Fe(NO)]2+
【解析】(1)①用KSCN溶液检出溶液中含有Fe3+;②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是两个实验过程均有O2但NaNO3溶液中无明显变化;③产生NO的电极上硝酸根离子得电子产生一氧化氮,发生还原反应,其电极反应式是NO2+e+H2O== NO↑+2OH;实验Ⅱ的目的是证实Fe2+被NO2氧化生成Fe3+;(2)①进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是将NO通入FeSO4溶液中溶液由浅绿色变黄色最后变棕色将NO通入Fe2(SO4)3溶液中无明显变化;②棕色溶液中的[Fe(NO)]2+受热生成Fe2+加热有利于Fe2+被氧化为Fe3+促进Fe3+水解产生Fe(OH)3沉淀;(3)①ⅰ中溶液变为棕色是因为亚铁离子被氮的氧化物氧化,发生反应的离子方程式是Fe2++NO2+2CH3COOH== Fe3++NO↑+H2O+2CH3COO、Fe2++NO== [Fe(NO)]2+; ②ⅲ中出现棕色的原因是两层液体界面上H+NO3与Fe2+反应生成棕色的[Fe(NO)]2+。


科目:高中化学 来源: 题型:
【题目】下列反应中既属于氧化还原反应,又属于吸热反应的是
A.灼热的碳与CO2反应B.Ba(OH)2·8H2O与NH4Cl反应
C.甲烷在氧气中燃烧D.铝片与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 
A.在t℃时,Ag2CrO4的Ksp为1×10﹣8
B.在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C.在t℃时,Ag2CrO4(s)+2Cl﹣(aq)2AgCl(s)+CrO42﹣(aq)平衡常数K=6.25×107
D.在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl﹣先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后
B.0.1 molL﹣1醋酸溶液中:c2(H+)=c(H+)c(CH3COO﹣)+KW
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO﹣)与pH的关系如图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(OH﹣)
D.在25℃时,将c molL﹣1的醋酸溶液与0.02 molL﹣1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10﹣9/(c﹣0.02)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除燃煤烟气中含有的SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是______。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是______。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42、NO3,均为放热反应。
①在如图中画出“放热反应”的反应过程中的能量变化示意图。
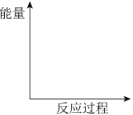
②NaClO溶液吸收烟气中SO2的离子方程式是______。
③一定时间内,温度对硫、硝脱除率的影响曲线如图,SO2的脱除率高于NO,可能的原因是______(写出1种即可)。

④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转化生成的NO3和Cl的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列叙述正确的是
A. 22.4L乙烷中含有的共价键数为7NA个
B. 常温下,28g乙烯和丙烯的混合物中总原子数为6NA个
C. 密闭容器中2 molNO与1molO2充分反应,产物的分子数为2NA
D. 标准状况下,11.2L二氯甲烷(CH2Cl2)所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 小苏打中加入过量的澄清石灰水:Ca2+ +2OH- +2HCO3- = CaCO3 ↓ +2H2O+ CO32-
B. 偏铝酸钠溶液中通入过量的CO2:CO2 +3H2O+2A1O2- = 2Al(OH)3↓十CO32-
C. Na2SO3 溶液使酸性 KMnO4溶液褪色:5SO32- + 6H++2MnO4-= 5SO42- + 2Mn2++ 3H2O
D. Fe(NO3)2 溶液中加入过量HI溶液:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com