
【题目】某元素原子 M 层电子数比 K 层电子数多 5 个,该元素的最高正价为
A.+7B.+5C.+3D.无最高正价
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】花椒毒素(Ⅰ)是白芷等中草药的药效成分,也可用多酚A为原料制备,合成路线如下:

回答下列问题:
(1)①的反应类型为_____________________;B分子中最多有_________个原子共平面。
(2)C中含氧官能团的名称为______________________;③的“条件a”为____________________。
(3)④为加成反应,化学方程式为__________________________________。
(4)⑤的化学方程式为__________________________________。
(5)芳香化合物J是D的同分异构体,符合下列条件的J的结构共有_________种,其中核磁共振氢谱为五组峰的J的结构简式为_________________。(只写一种即可)。
①苯环上只有3个取代基;②可与NaHCO3反应放出CO2;③1mol J可中和3mol NaOH。
(6)参照题图信息,写出以 为原料制备
为原料制备 的合成路线(无机试剂任选) :______________
的合成路线(无机试剂任选) :______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1~18号元素及其形成的化合物的化学式填空。
(1)原子半径最小的元素是________。
(2)除稀有气体元素外,原子半径最大的元素是________,它的原子结构示意图是________。
(3)与水反应最剧烈的金属是________。
(4)最高价氧化物对应的水化物碱性最强的是________。
(5)最高价氧化物对应的水化物为两性氢氧化物的是________。
(6)气态氢化物的水溶液呈碱性的元素是________。
(7)最稳定的气态氢化物是________。
(8)金属性最强的元素是________,非金属性最强的元素是________。
(9)最高价氧化物对应的水化物酸性最强的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2、NO3的反应。资料: [Fe(NO)]2+在溶液中呈棕色。

(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。

产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2、NO3的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L1的NaNO3溶液与1 mol·L1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定室温下NH3H2O的浓度及电离平衡常数Kb
(1)从三颈瓶中用(填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500molL﹣1HCl滴定.用pH计采集数据、电脑绘制滴定曲线如下图. 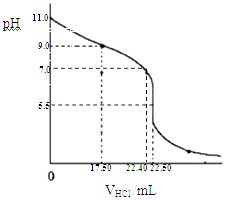
(2)据图,计算氨水的浓度为molL﹣1;写出NH3H2O电离平衡常数Kb的表达式,Kb= , 当pH=11.0时计算Kb的近似值,Kb≈ . (Kb保留两位有效数字)
(3)关于该滴定实验的说法中,正确的是 .
A.锥形瓶中有少量蒸馏水不影响测定结果
B.未滴加酸碱指示剂,实验结果不科学
C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高
D.滴定终点时俯视读数会导致测得氨水的浓度偏高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的MOH和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如下图所示。下列叙述正确的是

A. MOH为弱碱,HA为强酸
B. 水的电离程度:X=Z>Y
C. 若升高温度,Y、Z点对应溶液的pH均不变
D. 将X点溶液与Z点溶液等体积混合,所得溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料,可用于制取乙硎烷(B2H6),也可做有机合成的催化剂。某兴趣小组选用下列装置制备BCl3。

查阅资料:
①BCl3的沸点为12.5℃,熔点为-107.3℃,易水解;
②2B+6HCl![]() 2BCl3+3H2
2BCl3+3H2
请回答下列问题:
(1)装置A中盛浓盐酸的仪器名称为_________;装置A中发生反应的离子方程为___________。
(2)按气流方向连接各装置的接口,顺序为a→___→___→___→___→b→c→f→g→h,连接好装置后的第一步实验操作为_________。
(3)装置C中盛放的试剂为_________,实验中若不用装置C,可能产生的危险为_________。
(4)装置E的作用为__________________。
(5)常温下, KSP[Mn(OH)2]=1.0×10-13,向制取Cl2后的残余液中加入氢氧化钠溶液至Mn2+沉淀完全[c(Mn2+)≤1.0×10-5mol·L-1]溶液的PH最小为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径:Y>Z>R>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com