


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


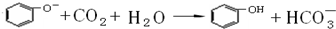
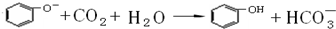
 CH3COONH4+H2O+2Ag↓+3NH3
CH3COONH4+H2O+2Ag↓+3NH3 CH3COONH4+H2O+2Ag↓+3NH3
CH3COONH4+H2O+2Ag↓+3NH3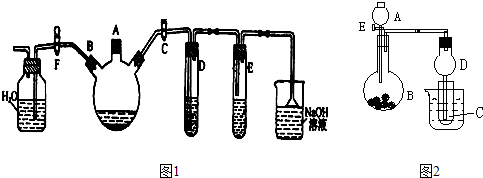
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列实验操作或对实验事实的叙述正确的是
(1)下列实验操作或对实验事实的叙述正确的是查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(四)化学试卷(B卷)(带解析) 题型:实验题
[2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为 。
②装置B的作用是 。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需 。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会 (填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是 。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是 。(选填序号)
| A.SO2溶解量太小 |
| B.SO2不与Fe3+发生反应 |
| C.H2SO3与BaCl2不反应 |
| D.装置中的空气与SO2进入水中也可生成H2SO4 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省临沂市苍山县高三上学期期末检测化学试卷 题型:填空题
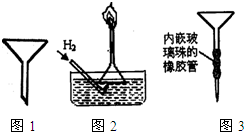
(15分)某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:

(1)SO2气体还原Fe3+的离子反应方程式为 ;
(2)实验中所需的SO2气体可以用浓硫酸和铜反应来制取,该反应的化学方程式为
,在反应表现了H2SO4的哪些性质 。
(3)装置C的作用是 。
(4)若要从A中得到溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填字母序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯
E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,不变红,紫色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀
上述方案不合理的一个方案 (填数字序号),原因是 。
(6)上述装置中能表明I-的还原性弱于SO2的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com