
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

分析 (1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;
(2)N原子核内有7个质子、核外有7个电子、两个电子层;氧化亚铜为砖红色;
(3)同一周期元素原子半径随着原子序数增大而减小;
同一周期元素电负性随着原子序数增大而增大;
原子晶体熔沸点与原子半径成反比;
不含氢键的分子晶体熔沸点与相对分子质量成正比;
(4)该原电池中,Cu作负极、Al作正极,正极上硝酸根离子得电子生成二氧化氮;电解质溶液中阳离子向正极移动、阴离子向负极移动,当浓硝酸浓度降低到一定程度是变为稀硝酸,Al易失电子而作负极.
解答 解:(1)Si原子核外有3个电子层、最外层电子数为4,所以位于第三周期第IVA族,
故答案为:三;ⅣA;
(2)N原子结构示意图为 ,氧化亚铜为砖红色,
,氧化亚铜为砖红色,
故答案为: ;砖红色;
;砖红色;
(3)同一周期元素原子半径随着原子序数增大而减小,所以原子半径Al>Si;
同一周期元素电负性随着原子序数增大而增大,所以电负性N<O;
原子晶体熔沸点与原子半径成反比,原子半径C<Si,所以熔沸点金刚石>晶体硅;
不含氢键的分子晶体熔沸点与相对分子质量成正比,相对分子质量甲烷<硅烷,所以熔沸点甲烷<硅烷;
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
点评 本题考查原子结构、元素周期律及原电池原理,为高频考点,侧重考查学生分析判断及知识的灵活运用能力,注意(4)题因为发生钝化现象而使Al开始做正极,反应到一定程度后Al作负极,为易错题.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O与Na2O2都是碱性氧化物 | |
| B. | 生石灰能与水反应,可用来干燥氨气 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 氯化铝是一种离子型电解质,可用于电解法制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
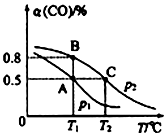
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于混合物的是②⑦⑧ | B. | 属于盐的是⑥⑩ | ||
| C. | 属于电解质的是⑤⑥⑦⑩ | D. | 属于分散系的是②⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化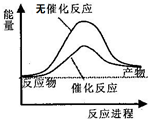 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com