
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成: 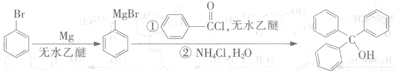
实验步骤如下:
①如图1所示,在三颈烧瓶中加入A,1.5 g镁屑,在滴液漏斗中加入,6.7 mL溴苯和无水乙醚,先加人1/3混合液于烧瓶中,待镁屑表面有气泡产生时,开始搅拌,并逐滴加入余下的混合液,使反应液保持微沸状态,至反应完全。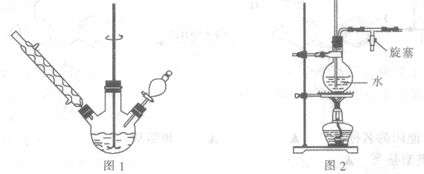
②继续加,A,3.7 g苯甲酰氯和无水乙醚,水浴回流l h 后,在冷水浴下慢慢滴加氯化铵的饱和溶液30.0 mL。
③将三颈烧瓶内的物质水浴加热蒸去乙醚,然后加,A,30.0 mL水进行水蒸气蒸馏(图2用作水蒸气发生装置),直至无油状物蒸出。
④冷却抽滤,将固体用80.0%的乙醇溶液重结晶,最终得到产品。
(1)步骤①中“逐滴加入余下的混合液”是为了防止 。
(2)若水蒸气蒸馏装置中出现堵塞现象,则图2玻璃管中水位会突然升高,此时应 ,待故障排除后再进行蒸馏。
(3)抽滤用到的主要仪器有气泵、 ,抽滤优于普通过滤的显著特点是 。
(4)步骤④中用80.0%的乙醇溶液重结晶的目的是 。
(5)用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法 。
(1)反应过于剧烈
(2)立即打开旋塞,移去热源
(3)布氏漏斗、吸滤瓶 过滤速度快
(4)提纯三苯甲醇
(5)红外光谱法 (每空2分,本题共1 2分)
解析试题分析:(1)该反应为放热反应,为控制反应速率,应逐滴加入余下的混合液;(2)若水蒸气蒸馏装置中出现堵塞现象,会出现爆炸现象,应及时停止反应和疏通,故应为立即打开旋塞,移去热源;(3)抽滤用到的主要仪器有气泵、布氏漏斗、吸滤瓶,其显著特点过滤速度快;(4)重结晶的目的一般是提纯;用光谱法可检验所得产物是否纯净,其中用来获得分子中含有何种化学键和官能团信息的方法是红外光谱法
考点:考查实验化学中实验操作目的、方法、实验仪器的选用等有关问题。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:实验题
将一定量铁粒放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。
(1)为探究溶液X中铁元素的价态,设计如下实验:
药品和仪器:0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性高锰酸钾溶液、氯水、试管和滴管。
请根据实验设计,填写下列实验报告:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | | |
| 第2步 | | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)铜陵有色股份有限公司电线电缆厂属国家电线电缆、绕组线行业专业生产厂。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的四位同学得知这一情况后,围绕“从含铜废料中回收铜”提出了各自的看法。甲同学根据已学知识,提出了一套回收方案:
乙同学在查阅资料后得知:在通入空气并加热的条件下,铜可与稀硫酸在溶液中发生反应(方程式为:2Cu+2H2SO4+O2 2CuSO4+2H2O ) ,于是他提出了另一套方案:
2CuSO4+2H2O ) ,于是他提出了另一套方案:
(1)甲方案的①、③两个步骤中,与铜或铜的化合物有关的化学反应方程式分别是:
① ;③ 。
(2)从环保角度对两套方案的不同部分进行比较,你认为 (填“甲”或“乙”)方案更合理,理由是: 。
(3)丙认为,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑。你认为丙这么说的道理是: 。
丁又提出了疑问:如果铁过量,剩余的铁粉会混在红色粉末中,该怎么处理呢?
请提出你的想法: 。
(4)最后,老师肯定了同学们的积极思考,但同时指出:方案最后一步所得浅绿色滤液结晶后,会得到一种俗称“绿矾”的工业产品,可增加经济效益。如果直接排放掉滤液,不仅造成了浪费,还会 。
(5)若上述方案所用的稀硫酸质量分数为36.8%,问每1000mL98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸 g,需水 mL(水的密度为1.0g/mL ) ,在实验室中稀释浓硫酸时,是如何操作的: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
精制氯化钾在工业上可用于制备各种含钾的化合物。完成下列填空:
(1)工业氯化钾中含有Fe3+、SO42—、Br—等杂质离子,可按如下步骤进行精制,完成各步内容。
①溶解;②加入试剂至Fe3+、SO42—沉淀完全,煮沸;③_____________________;④加入盐酸调节pH;
⑤___________________(除Br—);⑥蒸干灼烧。
步骤②中,依次加入的沉淀剂是NH3·H2O、________、________。
证明Fe3+已沉淀完全的操作是_________________________________________________。
(2)有人尝试用工业制纯碱原理来制备K2CO3。他向饱和KCl溶液中依次通入足量的______和______两种气体,充分反应后有白色晶体析出。将得到的白色晶体洗涤后灼烧,结果无任何固体残留,且产生的气体能使澄清石灰水变浑浊。
写出生成白色晶体的化学方程式:___________________________________________。
分析该方法得不到K2CO3的原因可能是_______________________________________。
(3) 用氯化钾制备氢氧化钾的常用方法是离子交换膜电解法。氢氧化钾在_________极区产生。为了避免两极产物间发生副反应,位于电解槽中间的离子交换膜应阻止_______(填“阴”、“阳”或“所有”)离子通过。
(4)科学家最近开发了一种用氯化钾制氢氧化钾的方法。其反应可分为5步(若干步已合并,条件均省略)。请写出第⑤步反应的化学方程式。
第①、②步(合并):2KCl + 4HNO3→ 2KNO3 + Cl2 + 2NO2 + 2H2O
第③、④步(合并):4KNO3 + 2H2O → 4KOH + 4NO2 + O2
第⑤步:____________________________________________
总反应:4KCl + O2 + 2H2O → 4KOH + 2Cl2
与电解法相比,该方法的优势可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学设计了以下流程检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是 ;步骤3的操作名称是 。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠
假设2:只含有 。
假设3:氯化钠和氢氧化钠都存在
(3)设计实验方案,进行试验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是 。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组对普通锌锰废干电池内的黑色固体进行探究,设计如下方案:
己知:I、普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。
II、氢氧化锌为白色粉末,不溶于水,溶于酸、强碱溶液和氨水。
请回答以下问题:
(1)②操作的名称是___________。
(2)某同学猜想溶液A的成分含有NH4Cl和ZnCl2,请你设计一个实验方案,验证其猜想正确,要求在答题卡上按下表格式写出实验操作、预期现象和结论。
限选试剂:蒸馏水、2moL·L-1 HCI 、2 moL·L-1 HNO3 、2 moL·L-1 NH3·H2O、6 moL·L-1 NaOH、0.1 moL·L-1 KSCN、0.1 moL·L-1 BaCl2、0.1 moL·L-1 AgNO3、紫色石蕊试液、红色石蕊试纸
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__ __________________________ | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管,__________ __________________________ | ______________________ | _______________________ |
| 步骤3:往c试管,__________ __________________________ | 先产生_______________, 后____________________ | 说明溶液A含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al203、Fe及其他不溶于酸、碱的杂质。部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
欲从含镍废催化剂中制得NiSO4·7H2O晶体,其流程如下:
请根据以上信息和流程图,回答下列问题:
(1)“碱浸”的目的是除去含镍废催化剂中的___ _。
(2)“酸浸”时所加入的酸是___ _。酸浸后,滤液②中可能含有的金属离子是___ 。(用离子符号表示)。
(3)“调pH为2—3的目的是___ _。
(4)步骤A的操作顺序是加热浓缩、冷却、____、____。
(5)NiSO4在强碱溶液中用NaC1O氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业生产纯碱的过程如下:
完成下列填空:
(1)粗盐水(含杂质离子Mg2+、Ca2+),加入沉淀剂A、B除杂质(A来源于石灰窑厂),则沉淀剂B 的化学式为 。
(2)实验室模拟由滤液制备滤渣的装置如下:
①图1中装置和图2中装置的连接方法为a接 ,b接 ,f接c。
②图2中试剂瓶内发生的化学反应方程式为 。
③实验中要求通入的NH3过量之后再通入CO2气体,检验通入的NH3已过量的实验操作是 。
(3)操作⑤煅烧后的纯碱中含有未分解的碳酸氢钠。某同学称取该纯碱样品m g,再充分加热至质量不再变化时称得剩余固体的质量为n g,则纯碱样品中碳酸钠的质量分数为 。
(4)现有25℃下,0.1mol/LNH3·H2O溶液和0.1mol/LNH4Cl溶液,将两份溶液等体积混合测得溶液的pH=9,下列说法正确的是 (填代号)。
a.0.1mol/L NH4Cl溶液与混合后溶液中导电粒子的种类和数目均相同
b.混合后的溶液中,c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c.由题意可知,NH3·H2O的电离程度大于同浓度的NH4Cl的水解程度
d.混合前两份溶液的pH之和大于14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com