
【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
(1)Al2O3+3Cl2+3C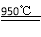 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2 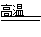 Fe3O4+CO2 (1分)
Fe3O4+CO2 (1分)
【解析】
试题分析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2――SO42-+2Cl-,再根据电荷守恒有SO32-+Cl2――SO42-+2Cl-+2H+,最后根据原子守恒得SO32-+Cl2+H2O=SO42-+2Cl-+2H+。
⑶由于升华器中含有AlCl3和FeCl3(杂质),加入少量Al,可与FeCl3反应将其除去。
⑷在含有FeCl3杂质的AlCl3产品中加入过量的NaOH溶液所发生的离子方程式有①Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O;沉淀物[Fe(OH)3]经洗涤、灼烧、冷却、称重,残留固体(Fe2O3)质量为0.32 g,据原子守恒可计算AlCl3产品的纯度: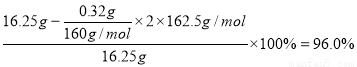 。
。
⑸为了抑制AlCl3的水解,必须在在HCl气流中加热AlCl3·6H2O,使其脱结晶水(否则会生成Al(OH)3或Al2O3)。
⑹据题意该反应的生成物有Fe3C、O2(空气),生成物有Fe3O4(磁性的固体)、CO2,根据氧化还原反应的配平方法将其配平,并标出反应条件(高温)。
考点:本题考查氧化还原反应方程式和离子方程式的书写、盐类的水解、根据化学反应方程式的化学计算(原子守恒)等。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源:2013-2014河北省保定市、定兴三中高二下学期期末化学试卷(解析版) 题型:选择题
某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见 的病毒与细菌。下面有关该物质的说法正确的是

A.该物质的分子式是C8H10ClO
B.1mol该物质最多可以与2mol NaOH反应
C.1mol该物质可以与2mol液溴发生取代反应
D.该物质可以发生加成、取代、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:简答题
Ⅰ:某课外活动小组用如图装置进行实验,试回答下列问题。

(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为
Ⅱ:下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
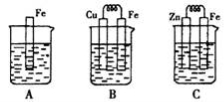
(3)B中若收集到224ml气体(标准状况),则溶解的金属质量为
(4)C中被腐蚀的金属是__________(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是_____________(用“>”表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是( )。
A.Y的阴离子Y 2-的还原性强于X的阴离子X-
B.X的含氧酸的酸性比Y的含氧酸的酸性强
C.X的单质X2能将Y的阴离子Y 2-氧化,并发生置换反应
D.X的氢化物比Y的氢化物稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省保定市第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列排列顺序不正确的是( )
A.热稳定性:CH4>SiH4>HF B.原子半径:Na>Mg>O
C.酸性:HClO4>H2SO4>H3PO4 D.非金属性:F>Cl>Br
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:

下列说法正确的是( )
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入过量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化
合物共有3种
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:推断题
(10分)已知:(X代表卤素原子,R代表烃基)

利用上述信息,按以下步骤从 合成
合成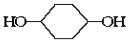 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)

请回答下列问题:
(1)分别写出B、D的结构简式:B____ 、D_ ____ __。
(2)反应①~⑦中属于消去反应的是____ _____。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:
_ 。
(4)试写出C D反应的化学方程式(有机物写结构简式,并注明反应条件)
D反应的化学方程式(有机物写结构简式,并注明反应条件)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
分子式为C5H11OH的同分异构体共有(不考虑立体异构)( )
A.6种 B.7种 C. 8种 D.9种
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:简答题
(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 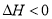 ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s) 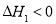
第2步:NH2COONH4(s)  CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。

(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。

①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
n/mol T/℃ | 活性炭 | NO | E | F |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2B. T1<T2C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com