
【题目】三氯化氮(NCl3)是一种淡黄色的油状液体,下面对于NCl3的描述不正确的是( )
A.NCl3为三角锥形B.NCl3是一种极性分子
C.它还能再以配位键与Cl-结合D.NCl3的挥发性比PBr3要大
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】(1)粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好选用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的_______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
=____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积不变的密闭容器中发生反应:![]() ,下列不能说明该可逆反应已经达到平衡状态的是( )
,下列不能说明该可逆反应已经达到平衡状态的是( )
A. 混合气体压强不再发生变化B. 混合气体质量不再发生变化
C. 反应中CO与![]() 的物质的量之比为1:1D. 生成n mol CO的同时生成n mol
的物质的量之比为1:1D. 生成n mol CO的同时生成n mol ![]() (g)
(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是

A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是:
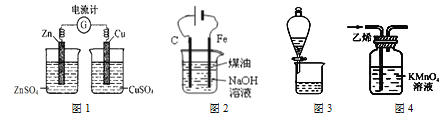
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家石油化工的发展水平,请回答下列问题。
(1)乙烯的电子式为________,结构简式为________。
(2)鉴别甲烷和乙烯的试剂可以是________(填序号)。
A.稀硫酸 B.溴水 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)已知![]() 。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
![]()
反应②的化学方程式为________________。
(5)工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物聚乙烯,其反应的化学方程式为________________,反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.SO3、![]() 、
、![]() 、
、![]() 的空间构型均为三角锥形
的空间构型均为三角锥形
C.NH3、![]() 、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
、H2O、H3O+、CH4中的N、O、C原子均是采取sp3杂化的
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式_____________。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:

①使用铜丝的优点是_____________________装置E的作用为_______________。
②装置C中盛放的药品可能是_________;
③装置D中的现象是_______________;装置F中反应的离子方程式是_______________。
(3)测定NaNO2和NaNO3 混合溶液中NaNO2的浓度。 取25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③NaNO2 的物质的量浓度为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铝土矿![]() 含
含![]() 、FeO、
、FeO、![]() 、
、![]() 中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量![]() :
:![]() 、
、![]() 、
、![]() 、
、![]()
B.通入过量氨气:![]() 、
、![]() 、
、![]() 、
、![]()
C.加入过量NaOH溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.加入过量NaClO溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com