
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:
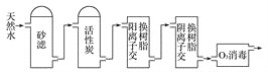
活性炭的作用是_______;O3消毒的优点是_______。
【答案】AD 加成反应 2ClO2+2CN-=2CO2+N2+2Cl- 产物为无毒无害的Cl-、CO2和N2 吸附水中的有机物(或除去水中的异味) 反应产物无毒无害
【解析】
(1)把握“原料分子中的原子全转变为所需产物”或“不产生副产物,实现零排放”,然后根据题给各选项观察反应物中所有原子是否都转化成了所需产物,据此判断反应类型的特点;
(2)先根据题意先确定反应产物:应将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,Cl元素由+4→-1价,C元素由+2→+4,N元素由-3→0价,然后再利用化合价升降法配平化学方程式;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒来解答;
杀菌消毒来解答;
(1)A. CH2=CH2+HCl→CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,A符合同一;
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
CH3CH2Cl+H2O中除目标产物CH3CH2Cl外,还有水生成,原子利用率不是100%,B不符合题意;
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
CH3CH2Cl+HCl中除目标产物CH3CH2Cl外,还有HCl生成,原子利用率不是100%,C不符合题意;
D.CH2=CHCl+H2![]() CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
CH3CH2Cl中所有原子是否都转化成了所需产物,原子利用率100%,D符合同一;
由上述四个反应可归纳出,原子经济性高的是加成反应;
(2)ClO2具有强氧化性,可以将CN-氧化成无毒的CO2和N2两种气体,而ClO2被还原为Cl-,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子反应为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-,其优点为产物都是无毒的气体(CO2和N2),不污染环境;
(3)根据流程图天然水![]() 去除水中不溶性杂质
去除水中不溶性杂质![]() 通过吸附作用去除有毒、有异味的分子
通过吸附作用去除有毒、有异味的分子![]() 去除水中的阳离子
去除水中的阳离子![]() 去除水中的阴离子
去除水中的阴离子![]() 杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。
杀菌消毒,所以活性炭的作用为吸附水中的有机物(或去除水中的异味),O3消毒的优点是反应产物是H2O,产物无毒、无害。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与图中四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
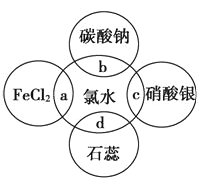
(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是________________,b过程中反应的离子方程式为________________。
(3)a过程中反应的化学方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某透明溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,某兴趣小组进行了如下实验.其中气体1在空气中能变为红棕色.
中的若干种离子,某兴趣小组进行了如下实验.其中气体1在空气中能变为红棕色.

上述反应中没有生成的气体是( )
A.NOB.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的有( )
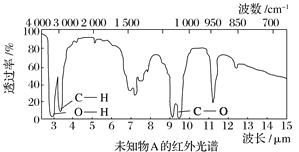
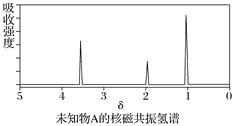
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
D. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除废水中的H2SiF6、F-,改善水质是环境部门的重要研究课题。
(1)AlF3是有机合成中常用催化剂,利用废水中的H2SiF6可转变制得,相关热化学方程式如下:
3H2SiF6(aq)+2Al(OH)3(s)=Al2(SiF6)3(aq)+6H2O(l);ΔH=akJ·mol-1
Al2(SiF6)3(aq)+6H2O(l)=2AlF3(aq)+3SiO2(s)+12HF(aq);ΔH=bkJ·mol-1
3HF(aq)+Al(OH)3(s)=AlF3(aq)+3H2O(l);ΔH=ckJ·mol-1
则反应H2SiF6(aq)+2Al(OH)3(s)=2AlF3(aq)+SiO2(s)+4H2O(l)的ΔH=___kJ·mol-1。
(2)废水的酸碱度及废水中的Fe3+对F-浓度的测定都会产生一定的影响。
①测定时,通常控制废水的pH在5~6之间。pH过小所测F-浓度偏低,其原因是___。
②Fe3+与柠檬酸根(C6F5O73-)、F-反应可表示为Fe3++nC6H5O73-![]() Fe(C6H5O7)n(3n-3)-、Fe3++nF-
Fe(C6H5O7)n(3n-3)-、Fe3++nF-![]() FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
FeFn(3-n)。向含有Fe3+的含氟废水中加入柠檬酸钠(C6H5O7Na3)可消除Fe3+对F-测定的干扰,其原因是___。
(3)利用聚苯胺可吸附去除水中F-。用惰性电极电解苯胺(![]() )和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
)和盐酸的混合液可在阳极获得聚苯胺薄膜,变化过程为:
![]()
写出阳极生成二聚体的电极反应式:___。
(4)利用MgCO3、Ca(OH)2和CaCO3等可沉淀去除废水中F-。
①以MgCl2溶液、尿素[CO(NH2)2]为原料可制得MgCO3,写出该反应的化学方程式:___。
②取三份相同的含F-的酸性废水,分别加入足量的MgCO3、Ca(OH)2和CaCO3。相同时间后溶液的pH及F-残留量如图1所示。实际废水处理过程中常选用MgCO3的优点除了F-残留率比较低之外,还有___。
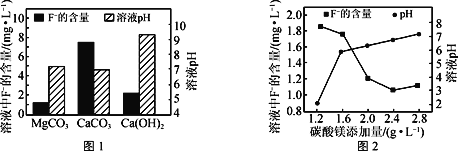
③改变碳酸镁添加量,处理后废水中F-含量及溶液pH的变化如图2所示。添加量超过2.4g·L-1后,溶液pH增大,使少量MgF2转化为Mg(OH)2,F-含量略有升高,此时溶液中的![]() =___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
=___。(已知:Ksp(MgF2)=8.0×10-11,Ksp[Mg(OH)2]=5.0×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作不正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定时,眼睛观察锥形瓶中溶液颜色的变化
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1为甲烷和![]() 构成的燃料电池示意图,电解质为KOH溶液,图2为电解
构成的燃料电池示意图,电解质为KOH溶液,图2为电解![]() 溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
溶液的装置,电极材料均为石墨.用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀.下列说法正确的是( )
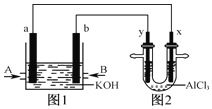
A.图1中电解质溶液的pH增大
B.图2中电解![]() 溶液的总反应为
溶液的总反应为![]()
C.A处通入的气体为![]() ,电极反应式为
,电极反应式为![]()
D.电解池中![]() 向x极移动
向x极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com