
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
科目:高中化学 来源: 题型:
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
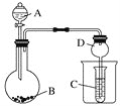
A. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
B. 若A为醋酸,B为贝壳,C中盛Na2SiO3,则C中溶液中变浑浊
C. 若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色
D. 实验仪器D可以起到防止溶液倒吸的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A. c(H+)= c(CH3COO-)+ c(OH-)
B. 加入少量CH3COONa固体后,c(CH3COO-)降低
C. 该溶液中由水电离出的c(H+)是1.0×10-11mol/L
D. 与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu。铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2,一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是( )
Fe2O3+3Cu。铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2,一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是( )
①甲中含有FeCl3;②甲中不含FeCl3;③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;④若向固体丙加稀盐酸有气体产生,则滤液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2。
A. ①③ B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
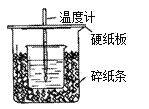
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_______________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_____________ (填“相等”或“不相等”)。
(5)此反应中和热的热化学方程式为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A. 一定条件下,将1g乙炔溶于12g苯,所得混合物中含有的碳原子数为NA
B. l04g苯乙烯(C6H5-CH=CH2)中含有8NA个碳氢键和NA个碳碳双键
C. 在100g质量分数为46%的乙醇水溶液中,含有氢原子数为6NA
D. lmol有机物CH3-CH=CH-CH3中最多有8NA个原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
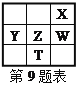
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com