
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
【答案】 TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol A 0.15mol·L-1·min-1 15% 0.56 < 50%
【解析】试题分析:(1)根据盖斯定律计算液态钠与四氯化钛置换出钛的热化学方程式;(2)①根据平衡标志分析;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;(3)①在t℃下,该反应的平衡常数为![]() ;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动;设NO的变化量为xmol,则
;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动;设NO的变化量为xmol,则![]() ;
;
解析:(1) ①Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
②2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
③Na(s) = Na(l) △H =2.6 kJ ·mol-1;
根据盖斯定律②![]() 2-③
2-③![]() 4-①,得液态钠与四氯化钛置换出钛的热化学方程式是TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol;(2)①A.4A(g)+B(s)
4-①,得液态钠与四氯化钛置换出钛的热化学方程式是TiCl4(l) +4Na(l) = Ti(s) +4NaCl(s) △H = -970.2kJ/mol;(2)①A.4A(g)+B(s) ![]() 3C(s)+4D(g),反应前后气体物质的量不变,气体的压强是恒量,所以恒温下,容器内的压强不再变化不一定达到平衡状态; B.4A(g)+B(s)
3C(s)+4D(g),反应前后气体物质的量不变,气体的压强是恒量,所以恒温下,容器内的压强不再变化不一定达到平衡状态; B.4A(g)+B(s) ![]() 3C(s)+4D(g)反应前后气体质量改变,根据
3C(s)+4D(g)反应前后气体质量改变,根据![]() ,密度是变量,所以恒温下,容器内混合气体的密度不再变化一定达到平衡状态;C.反应过程中D的物质的量增加,D的体积分数是变量,所以D的体积分数保持不变一定达到平衡状态; D.一定条件下,单位时间内消耗4molA的同时生成1 mol B,可知正逆反应速率相等,一定达到平衡状态;故选A;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;所以从反应开始到平衡时,A的平均反应速率为
,密度是变量,所以恒温下,容器内混合气体的密度不再变化一定达到平衡状态;C.反应过程中D的物质的量增加,D的体积分数是变量,所以D的体积分数保持不变一定达到平衡状态; D.一定条件下,单位时间内消耗4molA的同时生成1 mol B,可知正逆反应速率相等,一定达到平衡状态;故选A;②平衡后测得D的浓度为0.3mol·L-1,则消耗A的浓度是0.3mol·L-1;消耗A的物质的量是0.6mol、消耗B的物质的量是0.15 mol;所以从反应开始到平衡时,A的平均反应速率为![]() mol·L-1·min-1,B转化率为
mol·L-1·min-1,B转化率为![]() ;(3)①在t℃下,该反应的平衡常数为
;(3)①在t℃下,该反应的平衡常数为![]() =
=![]() ;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动,所以ΔH<0;设NO的变化量为xmol,则
;②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,说明升高温度平衡逆向移动,所以ΔH<0;设NO的变化量为xmol,则![]() ,x=0.05;此时NO的转化率为
,x=0.05;此时NO的转化率为![]() 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分为Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:

试回答下列问题:
(1)试剂X为__________;
(2)操作Ⅰ、操作Ⅱ均为_____________(填操作名称),在实验室进行该操作时需要的玻璃仪器有__________________________________;
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应,该反应的化学方程式为_______________________________,请举一例该反应的用途________________________;
(4)反应Ⅱ的离子方程式为____________________________________________________;
(5)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国的四大发明之一,深受世人称赞,其反应原理为:
S+3C+2KNO3![]() N2↑+3CO2↑+K2S
N2↑+3CO2↑+K2S
请回答下列相关问题:
(1)当产生0.1molN2时,反应中共转移电子数为_____,还原剂的物质的量为_____mol。
(2)若生成标准状况下33.6LCO2,则被S氧化的C的物质的量是_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒。
(1)某学生在实验室用密度为1.15g/mL,质量分数为15%的工业品过氧乙酸配制0.1mol/L过氧乙酸溶液250mL,该生用量筒量取工业品过氧乙酸体积___________________ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是__________________________________________________________________________。
(2)该学生配制前设计了下列操作,其合理的操作顺序是___________________________________________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需体积的工业品过氧乙酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的工业品过氧乙酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,倒置并振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高” 、“ 偏低”或“无影响”)?
a. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水_____________________;
b. 转移溶液时,不慎有少量溶液洒在容量瓶外___________________________;
c.量取15%的工业品过氧乙酸时,仰视量筒___________________________________;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线____________。
(4)下列叙述正确的是__________________(填字母)。
A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如右图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(5)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_________________________________________________________________________________________。
(6)如果生产过氧乙酸的原料CH3COONa中混有了SO42-,要想除掉SO42-请选择下列试剂按照加入先后顺序填空_________________________(试剂不必选完,填序号)。
①盐酸②醋酸钡溶液③氯化钡溶液④醋酸⑤碳酸钠溶液⑥碳酸氢钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体是介于AlCl3和A1(OH)3之间的一种水溶性无机高分子聚合物,其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产工艺流程如下:
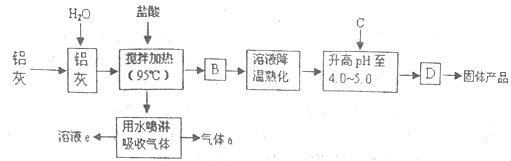
(1)反应中副产品a是______(用化学式表示);
(2)升高pH至4.0~4.5的目的是______;
(3)生产过程中可循环使用的物质是______(用化学式表示);
(4)为使得到的晶体较纯净,生产过程中使pH升高的C物质可选用______(填编号);
a.NaOHb.Alc.氨水d.A12O3e.NaAlO2
(5)聚合氯化铝晶体的化学式可表示为[A12(OH)nCl6-nH2O]m,实验室为测定n的值,进行如下操作:
①称取ag晶体,制成粉末,加热至质量不再变化时,得到bg。此过程可能用到的下列仪器有______;
a.蒸发皿 b.坩埚 c.研钵 d.试管
②另取a g晶体:用A试剂溶解→加足量AgNO3溶液→进行C操作→洗涤、烘干→称量为cg。则试剂A为______(填物质名称),C操作为______(填操作名称)。最后综合推算出n的值_____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读材料,完成下列问题。
海底盐池是近些年海洋科学家的一项重要发现,分布在世界多处埋有盐层的海域,目前人类已探明的海底盐池主要分布在红海、地中海、墨西哥湾、黑海、南极大陆架。盐池池面与普通海水之间有着清晰可见的分界。数不清的贝类与鱼虾在波光粼粼的盐池周围生活,但一旦生物进入盐池内就会死亡。研究人员还从盐池中采集了可以适应池中环境的生物样本,分析之后认为这类生物可能会在太阳系中某一行星上生存,甚至可能在太阳系之外也会存在。
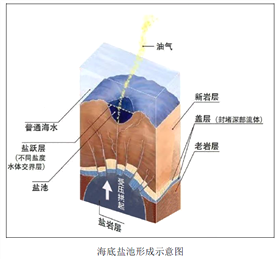

(1)结合材料,分析海底盐池的形成条件。
(2)简析池面与普通海水之间有明显分界的原因。
(3)推测生物一旦进入这个海底盐池就会死亡的原因。
(4)“海底盐池”会受到哪些领域专家的关注,并简述对“海底盐池”开展科考的现实意
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
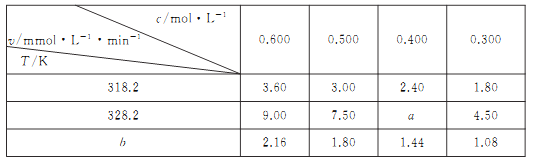
A. a=6.00 B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b>318.2 D. 不同温度时,蔗糖浓度减少一半所需的时间不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列各组物质能一步实现图中所示转化关系的是

选项 | X | Y | Z | W |
A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | CH3CH2Br | CH2=CH2 | C2H5OH | CH2BrCH2Br |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 电解熔融NaCl:2Cl-+2H2O ![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com