
| A. | 酸式盐的水溶液一定显碱性 | |
| B. | 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性 | |
| C. | 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 | |
| D. | 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍 |
分析 A、弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小;
B、酸碱强弱不同,元数不同酸碱性不同;
C、中性溶液中氢离子的浓度等于氢氧根离子的浓度;
D、碳酸是弱酸部分电离.
解答 解:A、弱酸的酸式盐存在电离和水解,溶液酸碱性取决于电离程度和水解程度大小,若NaHSO3溶液呈酸性,NaHCO3溶液呈碱性,故A错误;
B、酸碱强弱不同,元数不同酸碱性不同,如醋酸和氢氧化钠反应生成醋酸钠溶液显碱性,故B错误;
C、中性溶液中氢离子的浓度等于氢氧根离子的浓度,所以纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等,故C正确;
D、碳酸是弱酸部分电离,电离方程式为H2CO3  H++HCO3-,HCO3-
H++HCO3-,HCO3- H++CO32-以第一步电离为主,则氢离子浓度大于碳酸根离子浓度的2倍,故D错误;
H++CO32-以第一步电离为主,则氢离子浓度大于碳酸根离子浓度的2倍,故D错误;
故选C.
点评 本题考查了盐类水解和弱酸的电离的分析判断,溶液酸碱性的理解应用,掌握基础是关键,题目较简单,注意酸式盐溶液的酸碱性的判断.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用15N可以测定亚硝酸盐对地下水质的污染情况.
利用15N可以测定亚硝酸盐对地下水质的污染情况. ,15N2的结构式为15N≡15N;
,15N2的结构式为15N≡15N;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
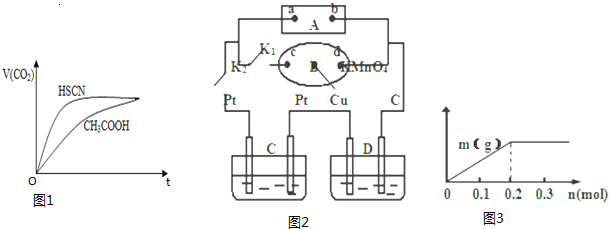
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2 (g),随温度升高,混合气体的颜色变深.反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度都为0.1mol•L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 | |
| C. | 向浓度都为0.1mol•L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 | |
| D. | 向0.1mol•L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
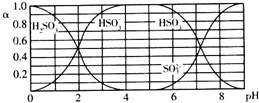
| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com