
【题目】(标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
(1)所得盐酸的物质的量浓度为_____?
(2)若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为的多少_____?;配制该浓度的溶液需要的玻璃仪器_____?
(3)将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为_____?
【答案】4mol/L 1mol/L 量筒、烧杯、玻璃棒、1000mL的容量瓶,胶头滴管 2.8升
【解析】
(1)先计算HCl的物质的量,再根据![]() 计算盐酸的物质的量浓度;
计算盐酸的物质的量浓度;
(2)根据![]() 计算稀释后盐酸的物质的量浓度;根据配制一定物质的量浓度的溶液的步骤分析使用的仪器。
计算稀释后盐酸的物质的量浓度;根据配制一定物质的量浓度的溶液的步骤分析使用的仪器。
(3)Zn与盐酸反应的方程式是Zn+2HCl=ZnCl2+H2,根据方程式计算生成氢气的体积。
(1)n( HCl)=![]() ,
,![]() 4mol/L;
4mol/L;
(2) ![]() ,则4mol/L×0.25L=c(稀)×1L,c(稀)= 1mol/L;根据配制一定物质的量浓度的溶液的步骤,配制该浓度的溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、1000mL的容量瓶,胶头滴管;
,则4mol/L×0.25L=c(稀)×1L,c(稀)= 1mol/L;根据配制一定物质的量浓度的溶液的步骤,配制该浓度的溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、1000mL的容量瓶,胶头滴管;
(3)250mL盐酸中HCl的物质的量是1mol/L×0.25L=0.25mol,设生成氢气的物质的量是xmol
Zn+2HCl=ZnCl2+H2
2 1
0.25mol xmol
![]()
x=0.125mol
标准状况下氢气的体积为0.125mol×22.4L/mol=2.8L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】【加试题】在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g) ![]() 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H
0;熵变△S 0 ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。

A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点X的浓度:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)请写出电解熔融氯化钠的反应方程式______________________________。如图为离子交换膜法电解饱和食盐水的原理示意图,下列说法正确的是________。
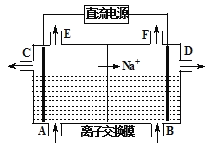
A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为3H2O+3O2![]() O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液,电解制高铁酸钾时阳极的电极反应式为______________________________。高铁酸钾长期放置会产生红色絮状物及气泡,则该过程的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于煤、石油、天然气等资源的说法正确的是 ( )
A.石油裂解得到的汽油是纯净物
B.石油、煤、可燃冰、植物油都属于化石燃料
C.天然气是一种清洁的化工原料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是 ( )
A.烷烃最少B.烯烃最少
C.炔烃最少D.三者一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g)![]() C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________mol/(L·s)。
(2)反应前A的物质的量浓度是________________mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
编号 | 改变的条件 | D的生成速率 |
① | 降低体系温度 | ______ |
② | 恒容下补充A气体 | ______ |
③ | 恒容下充入Ne(不参与体系反应) | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质溶于水后不能电离的是
A. 葡萄糖(C6H12O6) B. 氯化氢(HCl)
C. 氯化钠(NaCl) D. 氢氧化钡[Ba(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c molL-1,密度为ρ gcm-3,则下列说法正确的是
A. 溶液密度ρ可表示为cMr/1000w
B. 物质的量浓度c可表示为ρV/(MrV+22.4m)
C. 溶液的质量分数w%可表示为:MrV/22.4m
D. 相对分子质量Mr可表示为:(22.4m×w%)/((1-w%)V)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.CO2的水溶液导电,所以CO2是电解质
C.铜、石墨均导电,所以它们都是电解质
D.蔗糖在水溶液中和熔融时均不导电,所以蔗糖是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com