
【题目】下列说法正确的是![]()
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.溶液与胶体:本质区别是能否发生丁达尔效应
C.常温下可以用铝或铁制容器贮存浓硝酸和浓硫酸
D.用焰色反应鉴别NaCl溶液和![]() 溶液
溶液
【答案】C
【解析】
A.酸指电离时所有阳离子都是氢离子的化合物;碱指电离时所有阴离子都是氢氧根离子的化合物;盐指由金属阳离子(铵根)和酸根离子构成的化合物;两种元素组成的化合物,其中一种是氧元素的称为氧化物,硫酸是酸,纯碱是盐,醋酸钠是盐,生石灰是氧化物,故A错误;
B.胶体和溶液的本质区别分散质粒子直径的大小,分散质微粒直径小于1nm形成的分散系为溶液,分散质微粒直径为![]() 形成的分散系为胶体,故B错误;
形成的分散系为胶体,故B错误;
C.常温下,铝或铁遇到浓硫酸或浓硝酸发生氧化反应在金属的表现生成了一层致密的氧化膜,保护了内部金属不再被氧化,故C正确;
D.NaCl溶液和![]() 溶液中都含有钠元素,焰色反应都呈黄色火焰,不能用焰色反应鉴别,故D错误;
溶液中都含有钠元素,焰色反应都呈黄色火焰,不能用焰色反应鉴别,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】今年是门捷列夫诞辰180周年。下表是元素周期表的一部分,粗线是其边界。下列说法不正确的是

A.最高价氧化物水化物的酸性:乙>丁
B.甲的一种单质是自然界最硬的物质
C.戊元素位于第4周期第VIII族
D.乙、丙的最高价氧化物的水化物可以反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验探究小组研究320K时N2O5的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
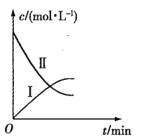
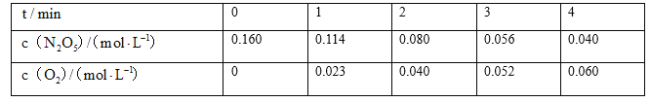
A.曲线I是N2O5的浓度变化曲线
B.曲线Ⅱ是N2O5的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.O2的浓度越大,反应速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
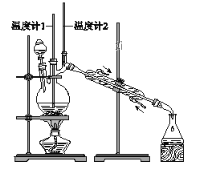
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2![]() 2NH3△H=-92.4kJ/mol
2NH3△H=-92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为______。
此温度下该反应的平衡常数K=__________。
②欲提高H2的转化率,下列措施可行的是___________。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
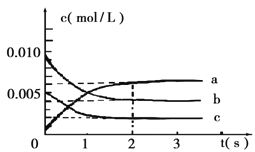
①用O2表示从0~2s内该反应的平均速率υ=___________。
②能说明该反应已经达到平衡状态的是_________。
a.υ(NO2)=2υ(O2)
b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
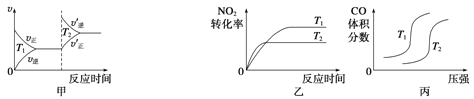
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为铅蓄电池的示意图。下列说法正确的是( )
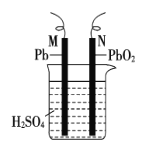
A.充电时,若N连电源正极,则该极生成PbO2
B.放电时,c(H2SO4)不变,两极的质量增加
C.放电时,N为负极,其电极反应式为PbO2+SO![]() +4H++2e-=PbSO4+2H2O
+4H++2e-=PbSO4+2H2O
D.充电时,阳极反应式为PbSO4+2e-=Pb+SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年化学科学家用微生物燃料电池作电源进行模拟消除酸性工业废水中的重铬酸根离子(Cr2O72-)的示意图如图所示,反应一段时间后,在装置②中得到Fe(OH)3和Cr(OH)3两种沉淀。已知6Fe2++ Cr2O72-+14H+=6Fe3++2Cr3++7H2O。下列说法错误的是( )

A.装置①中,a极的电极反应为HS--8e-+4H2O=SO42-+9H+
B.向装置②中加入适量Na2SO4,其主要作用是增强溶液的导电性
C.装置①中,b极上消耗的n(O2)与装置②中惰性电极上生成的n(生成物)相等
D.当装置①中有0.6mol H+通过质子交换膜时,装置②中产生0.4mol沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。
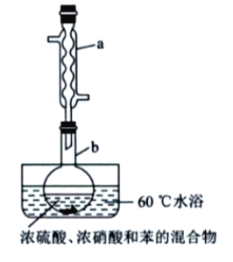
下列说法不正确的是( )
A. 水浴加热的优点为使反应物受热均匀、容易控制温度
B. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加人浓硫酸,待冷却至室温后,将所得混合物加入苯中
C. 实验过程中发现仪器b中未加入碎瓷片,可冷却后补加
D. 反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO![]()
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO![]() 、SO
、SO![]()
C.含有Ca2+的溶液中:Na+、K+、CO![]() 、Cl-
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com